-
下列叙述中,从化学角度分析不正确的是( )
A. 长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气体减少形成“负压”的缘故
B. 硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说:“硅是信息技术革命的催化剂”
C. “雨后彩虹”、“海市蜃楼”既是一种光学现象,也与胶体的知识有关
D. “水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故
难度: 简单查看答案及解析
-
设NA代表阿佛加德罗常数,下列说法错误的是( )
A. 46g NO2和46g N2O4含有的原子数均为3NA
B. 0.1mol·L-1的100mLH2SO4溶液中,含有的离子数约为0.03 NA
C. 常温常压下,活泼金属从盐酸中置换出1mol H2,发生转移的电子数为2NA
D. 在铜与硫的反应中,1mol铜失去的电子数为2 NA
难度: 中等查看答案及解析
-
下列指定溶液中一定能大量共存的离子组是( )
A. pH=1的溶液中:NH4+、Na+、Al3+、SO42-
B. 含有大量AlO2-的溶液中:Na+、K+、HCO3-、NO3-
C. 中性溶液中:K+、Fe3+、Cl-、SO42-
D. Na2S溶液中:SO42-、K+、Cu2+、Cl-
难度: 中等查看答案及解析
-
利用下列装置分别完成相关实验,不能达到实验目的的是( )
A
B
C
D
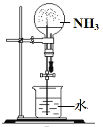
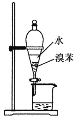
证明NH3极易溶于水
分离出溴苯
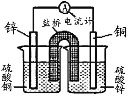
设计成铜锌原电池
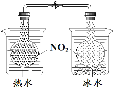
证明温度对平衡移动的影响
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A. CaCO3溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
B. FeCl2溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
C. AlCl3溶液跟过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D. Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
难度: 简单查看答案及解析
-
某燃料电池以熔融的金属氧化物为电解质、CH4为燃料,该电池工作原理如图所示。下列说法不正确的是( )

A. a为CH4,b为空气
B. O2-向负极移动
C. 此电池在常温时也能工作
D. 正极电极反应式为O2+4e-===2O2-
难度: 简单查看答案及解析
-
向1mol·L-1的KAl(SO4)2溶液中滴入Ba(OH)2溶液,当生成沉淀的质量最大时,铝元素的主要存在形式为( )
A. Al3+和Al(OH)3 B. Al(OH)3
C. AlO2- D. AlO2-和Al(OH)3
难度: 中等查看答案及解析
-
将一定量的氨气通入稀盐酸发生中和反应,下列说法错误的为( )
A. 当溶液中c(Cl-)=c(NH4+)时,该溶液一定呈中性
B. 当溶液中氨与盐酸恰好完全中和时,c(Cl-)=c(NH4+)
C. 当溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)时,可能是盐酸过量
D. 若溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)时,一定是氨气过量
难度: 中等查看答案及解析
-
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A. 1.7 B. 2.0 C. 12.0 D. 12.4
难度: 简单查看答案及解析
-
某芳香烃的分子式为C7H8,它的一氯代物有( )
A. 4种 B. 5种 C. 6种 D. 7种
难度: 简单查看答案及解析
-
下列说法或表示法正确的是( )
A. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B. 己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
C. 在稀溶液中:H++OH-=H2O ΔH=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
D. 101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧的热化学方程式可以表示为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8 kJ·mol-1
难度: 中等查看答案及解析
-
一定温度下,在某容积一定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)+H2(g)。不能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2)
C. 1 mol H—H键断裂的同时断裂2 mol H—O键
D. 生成n mol CO的同时消耗n mol H2O
难度: 中等查看答案及解析
-
某温度下,某反应达平衡时平衡常数K=c(C)·c(D)/c(A)·c(B)。恒容时,温度升高,C的物质的量浓度减小。下列说法正确的是( )
A. 该反应的焓变ΔH>0
B. 恒温恒容时,增大体系压强,c(D)一定增大
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式可能为A(g)+B(g)
C(g)+D(g)
难度: 中等查看答案及解析
-
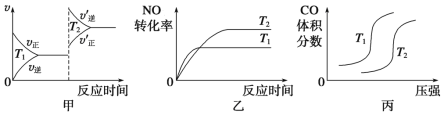
反应2NO2(g)
N2O4(g) ΔH=-57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的为( )
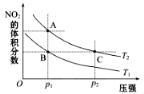
A. A、C两点气体的颜色:A深,C浅
B. A、C两点的反应速率:A>C
C. A、C两点气体的平均相对分子质量:A>C
D. 由状态A到状态B,可以采用降温的方法
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 凡是吸热反应都是非自发的
B. 自发反应的熵一定增大,非自发反应的熵一定减小
C. 常温下,反应C(s)+CO2(g===2CO(g)不能自发进行,则该反应的ΔH<0
D. 反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH<0
难度: 中等查看答案及解析
-
25 ℃时加水稀释10 mL pH=11的氨水,下列判断不正确的是( )
A. 原氨水的浓度大于10-3mol·L-1
B. 溶液中c(NH4+)/c(NH3·H2O)增大
C. 氨水的电离程度增大,溶液中所有离子的浓度均减小
D. 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 常温下,某溶液中由水电离出的c(H+)=1×10-amol·L-1,若a>7时,则该溶液的pH值可能为14-a或a
B. pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度不相同
C. 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数不变
D. 常温下,向纯水中加入少量NH4Cl固体,水的电离平衡正移,Kw变大
难度: 中等查看答案及解析
-
室温下,用0.100mol·L-1NaOH溶液分别滴定20.00mL0.100mol·L-1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )

A. Ⅱ表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)等于20mL
C. V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
下列过程中所发生的化学变化属于取代反应的是( )
①乙酸与乙醇反应生成乙酸乙酯;②乙烯通入溴水中;③在镍作催化剂的条件下,苯与氢气反应;④苯与液溴混合后撒入铁粉
A. ①② B. ①③ C. ②④ D. ①④
难度: 简单查看答案及解析
-
下列有关于电解质溶液的说法中不正确的是( )
A. pH相等的四种溶液:a.CH3COONa、b.NaClO、c.NaOH,溶质的物质的量浓度由小到大的顺序为c<b<a
B. 向NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=c(SO42-)
C. 已知醋酸的电离平衡常数为Ka,醋酸根离子的水解常数为Kh,水的离子积常数为Kw,则三者关系为Ka·Kh=Kw
D. 甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的2倍,则甲、乙两溶液等体积混合,混合溶液的pH可能等于7
难度: 中等查看答案及解析
-
将SO2气体通入BaCl2和FeCl3的混和溶液中,有白色沉淀生成,此沉淀的化学式为( )
A. BaSO4 B. S C. BaSO3 D. FeS
难度: 简单查看答案及解析
-
在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31
Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
A. Fe3+ B. Cr3+ C. Zn2+ D. Mg2+
难度: 中等查看答案及解析
-
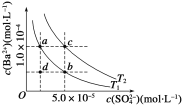
已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论不正确的是( )[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为1mol·L-1
B. 图中x点的坐标为(100,6)
C. 图中x点表示溶液中AgNO3与NaCl恰好完全反应
D. 把0.1mol·L-1的NaCl换成0.1mol·L-1NaI则图像在终点后变为虚线部分
难度: 中等查看答案及解析
-
下列事实中,能说明氯的非金属比碳强的是( )
A. 盐酸的酸性比碳酸强
B. 次氯酸的氧化性比碳酸强
C. 氯化氢比甲烷的热稳定性好
D. 氯原子最外层电子数比碳原子最外层电子数多
难度: 中等查看答案及解析
-
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )
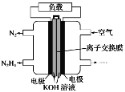
A. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
B. 电子从右侧电极经过负载后流向左侧电极
C. 负极发生的电极反应式为N2H4+4OH--4e-===N2+4H2O
D. 该燃料电池持续放电时,OH-从正极向负极迁移,因而离子交换膜需选用阴离子交换膜
难度: 中等查看答案及解析