-
化学与社会、生活密切相关。对下列现象或事实的解释中正确的是
选项
现象或事实
解释
A
液氨可用作制冷剂
NH3的化学性质稳定,不易发生反应
B
小苏打片用于治疗胃酸过多
Na2CO3能与盐酸反应,降低胃液的酸度
C
SO2可用作葡萄酒的食品添加剂
SO2具有漂白性,能杀菌、消毒
D
Al(OH)3用作塑料等材料的阻燃剂
受热易分解生成Al2O3和H2O,同时吸收热量
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数。下列说法正确的是
A. 常温常压下,14 g乙烯和环丙烷混合气体中碳原子数为NA
B. 标准状况下,11.2 L乙烷含有共价键数为3NA
C. 密闭容器中充入1 mol I2 和2 mol H2充分反应,生成HI分子数为2NA
D. Na2O2与CO2反应时,生成0.5 mol O2转移的电子数为2NA
难度: 中等查看答案及解析
-
实验是化学研究的基础。下列关于各实验装置的叙述正确的是
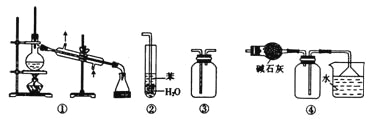
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置③可用于收集H2、CO2、Cl2、NH3等气体
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. c(H+)=1.0×10-12 mol/L的溶液:K+、Mg2+、CH3COO-、Br-
B. 甲基橙呈红色的溶液:NH4+、Ba2+、Cl-、 NO3-
C. 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
D. 含1.0 mol/L KNO3的溶液:Cl-、SO42-、H+、Fe2+
难度: 中等查看答案及解析
-
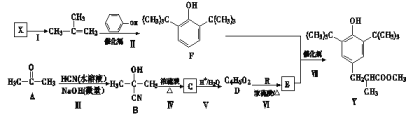
自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(
),杏仁含苯甲醛(
)。下列说法错误的是
A. 肉桂醛能发生加成反应、取代反应和加聚反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
难度: 中等查看答案及解析
-
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A. 原子半径由小到大的顺序:X< Y < Z< W
B. Z的最高价氧化物能与水反应生成相应的酸
C. 室温下,0.1 mol/L W的气态氢化物的水溶液的pH > 1
D. Y单质在一定条件下可以与氧化铁发生置换反应
难度: 中等查看答案及解析
-
下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
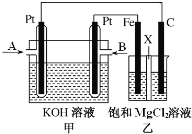
A. 甲中A处通入CH4,电极反应式为CH4 + 10OH- - 8e-
CO32-+ 7H2O
B. 乙中电解MgCl2溶液的总反应为2Cl- + 2H2O
Cl2↑+H2↑+2OH-
C. 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D. 甲、乙中电解质溶液的pH都增大
难度: 中等查看答案及解析