-
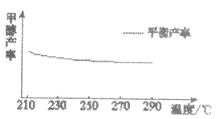
控制变量是科学研究的重要方法。向2mLH2O2溶液中滴入2滴1mol/L FeCl3溶液,下列条件下分解速率最快的是
选项
H2O2溶液的物质的量浓度/ mol·L-1
反应的温度/℃
A
1
5
B
4
5
C
1
40
D
4
40
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
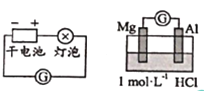
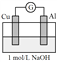
下列图示内容的对应说明错误的是
A
B
C
D
图示
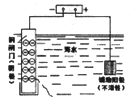
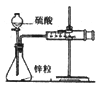
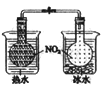
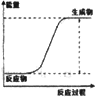
说明
可保护钢闸门不被腐蚀
可以结合秒表测量锌与硫酸的反应速率
证明温度对平衡移动的影响
反应为放热反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应A(s)+3B(g)
2C(g)+D(g)已达平衡状态的是
A. B的物质的量浓度 B. 混合气体的密度
C. 混合气体的压强 D. v(B消耗)=3v(D消耗)
难度: 中等查看答案及解析
-
工业合成氨N2+3H2
2NH3
H<0的生产条件选择中能用勒夏特列原理解释的是①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
难度: 中等查看答案及解析
-
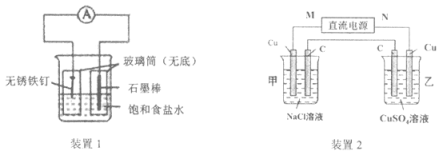
下列有关2个电化学装置的叙述正确的是
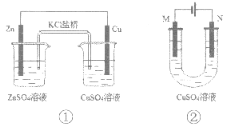
A. 装置①中,电子移动的路径是:Zn→Cu→CuSO4溶液→KCl盐桥→ZnSO4溶液
B. 在不改变总反应的前提下,装置①可用Na2SO4替换ZnSO4,用石墨替换Cu棒
C. 装置②中采用石墨电极,通电后,由于OH-向阳极迁移,导致阳极附近pH升高
D. 若装置②用于铁棒镀铜,则N极为铁棒
难度: 中等查看答案及解析
-
一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。

关于此反应的说法不正确的是
A. 反应物总能量一定低于生成物总能量 B. 一定属于可逆反应
C. 一定有非极性共价键断裂 D. 一定属于氧化还原反应
难度: 困难查看答案及解析
-
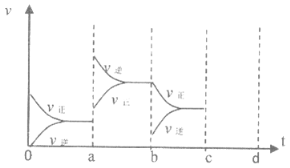
反应C+CO2
2CO
H>0。升高温度,关于该反应v正和v逆的说法正确的是
A. v正增大,v逆减小 B. v正增大,v逆不变
C. 同时减小 D. 同时增大
难度: 中等查看答案及解析
-
一种锂铜可充电电池,工作原理如图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法不正确的是
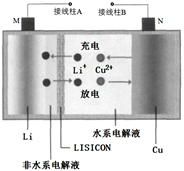
A. 陶瓷片允许Li+ 通过,不允许水分子通过 B. 放电时,N为电池的正极
C. 充电时,阴极反应为:Li++e−=Li D. 充电时,接线柱A 应与外接电源的正极相连
难度: 中等查看答案及解析
-
可从铅蓄电池中回收铅,实现铅的再生。在工艺中得到含Na2PbCl4的电解液,电解Na2PbCl4溶液后生成Pb,如图所示。下列说法不正确的是

A. 阳极区会有气泡冒出,产生O2
B. 一段时间后,阳极附近pH明显增大
C. 阴极的电极反应方程式为PbCl42−+ 2e−
Pb + 4Cl-
D. Na2PbCl4浓度下降后可在阴极区加入PbO,实现电解液的继续使用
难度: 中等查看答案及解析
-
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池
电解池
A
H+移向Pb电极
H+移向Pb电极
B
每消耗3molPb
生成2molAl2O3
C
正极:PbO2+4H++2e—=Pb2++2H2O
阳极:2Al+3H2O-6e—=Al2O3+6H+
D
难度: 简单查看答案及解析
-
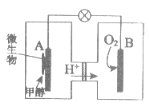
微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是
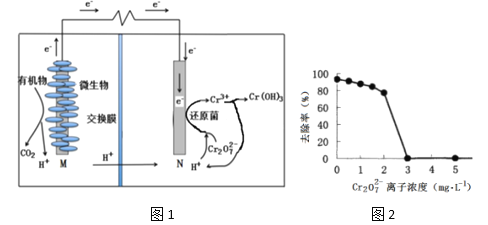
A. M为电源负极,有机物被氧化
B. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
C. 电池工作时,N极附近溶液pH增大
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
难度: 中等查看答案及解析
-
对于反应H2(g)+I2(g)
2HI(g)
H<0,下列说法正确的是
A. 反应达到平衡后,缩小容器体积,混合气体平均相对分子质量变小
B. 反应达到平衡后,保持容器温度和体积不变,充入HI气体,再次达到平衡,H2转化率减小,平衡常数K值减小
C. 若v正(H2)=2v逆(HI),反应达到平衡状态
D. 反应达到平衡后,保持容器体积不变,升温,反应体系的颜色加深
难度: 中等查看答案及解析
-
高温下,反应CO+H2O
CO2+H2 达平衡。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为负值
B. 恒温恒容下,增大压强,平衡一定不动
C. 升高温度,正反应速率减小
D. 平衡常数
难度: 中等查看答案及解析
-
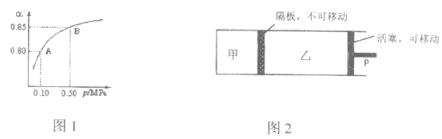
已知:N2(g) + 3H2(g)
2NH3(g) ΔH = − 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
难度: 中等查看答案及解析
-
控制适当的条件,将反应2Fe3++2I-
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是

A.反应开始时,乙中电极反应为2I--2e-= I2
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.平衡时甲中溶入FeCl2固体后,电流计读数为零
难度: 简单查看答案及解析
-
下列叙述中,一定能判断化学平衡移动的是
A. 混合物中各组分的浓度改变
B. 正、逆反应速率改变
C. 混合物中各组分的百分含量改变
D. 混合体系的压强改变
难度: 中等查看答案及解析
-
在10 L密闭容器中充入气体X和Y,发生反应X(g)+Y(g)
M(g)+N(g),所得实验数据如下表:
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.40
0.10
0.080
③
800
0.20
0.05
A
下列说法正确的是
A. ①中,若5 min末测得n(M)=0.050 mol,则0至5 min内,用N表示的平均反应速率v(N)=1.0×10-2 mol/(L·min)
B. ③中,达到平衡时,Y的转化率为80%
C. 800℃,该反应的平衡常数K=2.0
D. 反应焓变
H>0
难度: 中等查看答案及解析
-
某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l)
2 CrO42-(aq)(黄色)+2H+(aq) ∆H=+13.8kJ·mol-1
步骤:
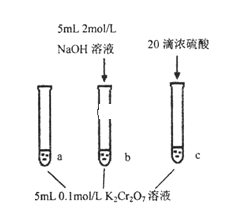
现象:
待试管b中颜色不变后与试管a比较,
溶液颜色变浅。
滴加浓硫酸,试管c温度略有升高,
溶液颜色与试管a相比,变深。
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
难度: 困难查看答案及解析
-
某同学使用石墨电极,在不同电压(x)下电解pH=1的FeCl2溶液,实验记录如下(a、b代表电压数值)
序号
电压/V
阳极现象
检验阳极产物
I
x≥a
电极附近出现黄色,有气泡产生
有Fe3+、有Cl2
II
a>x≥b
电极附近出现黄色,无气泡产生
有Fe3+、无Cl2
III
b>x≥0
无明显变化
无Fe3+、无Cl2
下列说法中,不正确的是
A. I中阳极附近的溶液可使KI淀粉试纸变蓝
B. II中出现黄色可能是因为Fe2+有还原性,在阳极放电产生Fe3+
C. 由II中阳极现象可知,该电压下Cl-在阳极不放电
D. 根据表中电压与阳极现象及产物的对应,可以看出离子是否放电与电压有关
难度: 困难查看答案及解析