-
化学与人类社会的生产、生活有着密切联系。下列叙述中正确的是
A. 铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
B. 铝制品由于表面有致密的氧化膜,可以稳定存在于空气中
C. 苹果放在空气中久置变黄和漂白过纸张久置变黄原理相似
D. 高纯度的SiO2对光有很好的折射和全反射作用,可以制成光电池将光能直接转化为电能
难度: 中等查看答案及解析
-
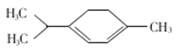
A. 5种 B. 6种
C. 7种 D. 8种
难度: 困难查看答案及解析
-
下列离子方程式正确的是
A. 金属钠与水反应:Na+ H2O=Na++ H2
B. 氯化铵溶液显酸性的原因:NH4++H2O=NH3·H2O+H+
C. AICl3溶液中加入足量氨水:Al3++4NH3-H2O= AlO2-+4NH4+2H2O
D. 氯化铁溶液中滴加少量的硫化氢溶液:2Fe3++H2S= 2Fe2++S+2H+
难度: 中等查看答案及解析
-
丙烯酸的结构简式为CH2= CH-COOH,下列关于丙烯酸的说法错误的是
A. 丙烯酸可以发生取代反应
B. 丙烯酸可以使酸性高锰酸钾溶液褪色
C. 丙烯酸与HBr发生加成反应只能得到唯一产物
D. 丙烯酸钠溶液中Na+浓度大于丙烯酸根离子浓度
难度: 中等查看答案及解析
-
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,质量最大的是Z
B. 相同条件卜,同质量的二种气体,气体密度最小的是X
C. 若一定条件下,三种气体体积均为2. 24 L,则它们的物质的量一定均为0.1moI
D. 同温下,体积相同的两容器分别充2gY气体和lgZ气体,则其压强比为2:1
难度: 困难查看答案及解析
-
某兴趣小组用下图装置制备气体(酒精灯可以根据需要选择),对应说法正确的是
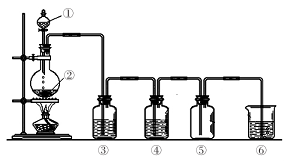
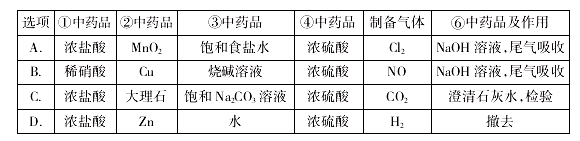
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 室温下向1LpH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA
B. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
C. 某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA
D. 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0kI/mol,乙烯与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA
难度: 简单查看答案及解析
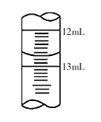
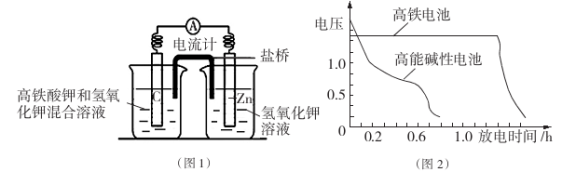
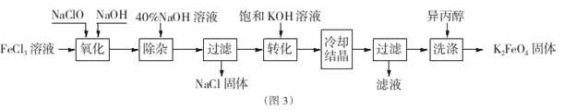
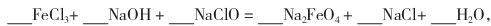
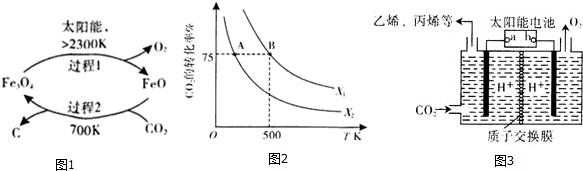
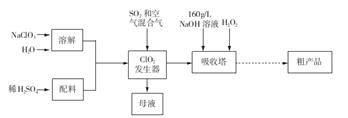
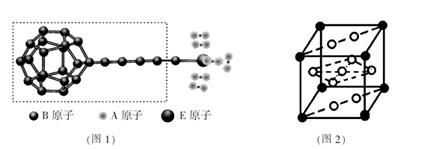
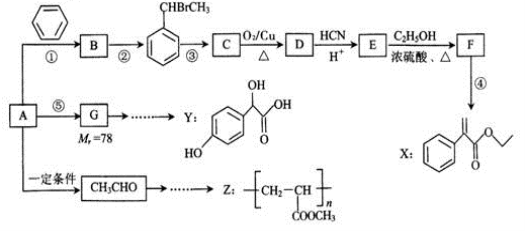
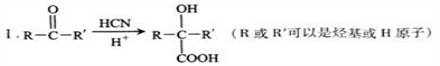
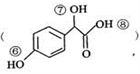 的说法正确的是_________________。
的说法正确的是_________________。