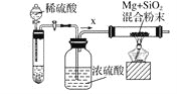
-
使5.16 g 二氧化碳和水蒸气的混合气体通过足量的过氧化钠,固体增重1.96 g,则参加反应的过氧化钠质量为( )
A. 7.8 g B. 3.9 g C. 3.2 g D. 15.6 g
难度: 中等查看答案及解析
-
下列关于氯气的说法不正确的是( )
A. 氯气和液氯是两种不同的物质
B. 可以用浓硫酸除去氯气中的水蒸气
C. 氯气是一种有毒气体,但可用于自来水的杀菌消毒
D. 尽管氯气的化学性质很活泼,但是纯净的液氯能用钢瓶贮存
难度: 简单查看答案及解析
-
已知X和Y能发生如下反应:X+Y=H2O+盐,下列有关物质X和Y所属种类的判断中一定不正确的是( )
A. X为酸、Y为碱 B. X为碱性氧化物、Y为酸
C. X为盐、Y为碱 D. X为碱性氧化物、Y为酸性氧化物
难度: 中等查看答案及解析
-
现有三组溶液:①煤油和氯化钾溶液、②35%的乙醇溶液、③碘单质和氯化钠固体,分离以上各混合体系最合适的方法依次是( )
A. 分液、蒸馏、萃取 B. 萃取、蒸馏、升华
C. 分液、蒸馏、升华 D. 蒸馏、分液、萃取
难度: 中等查看答案及解析
-
实验室贮存下列物质的溶液时,必须用棕色瓶的是( )
①浓硝酸 ②浓硫酸 ③浓盐酸 ④硝酸银溶液
A. ①④ B. ②③ C. ①③ D. ②④
难度: 中等查看答案及解析
-
某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为 4A=B+2C+2D,测得生成的混合气体对氢气的相对密度为2 d,则A的相对分子质量为( )
A. 7d B. 5d C. 2.5d D. 2d
难度: 困难查看答案及解析
-
下列实验操作正确的是( )
A. 先装好药品,再检查装置的气密性
B. 先用双手捂紧试管,再将导管插入水中检查装置的气密性
C. 氢气还原氧化铜的实验,先通一段时间的氢气,后加热
D. 稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 能电离出氢离子的化合物叫做酸 B. 能电离出氢氧根离子的化合物叫做碱
C. 能电离出酸根离子的化合物叫做盐 D. 由金属离子和酸根离子组成的化合物属于盐
难度: 中等查看答案及解析
-
32 g某气体的分子数目与22 g 二氧化碳的分子数目相同,则该气体的摩尔质量为 ( )
A. 32 g B. 32 g·mol-1 C. 64 g·mol-1 D. 64 g
难度: 简单查看答案及解析
-
某硝酸的物质的量浓度为cmol·L-1,溶质的质量分数为a%,则此溶液的密度(g·cm-3)为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
实验室用自来水制蒸馏水的实验装置如下图所示:
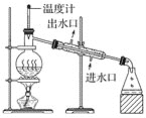
下列关于该实验的叙述中正确的是( )
A. 用到的玻璃仪器有:酒精灯、蒸馏烧瓶、冷凝管和锥形瓶
B. 进行蒸馏实验时,装置内部应保持与大气相通以保证安全
C. 实验结束时应该先停止通冷凝水,后熄灭酒精灯
D. 取锥形瓶内少量液体,加入硝酸银溶液有白色沉淀生成
难度: 简单查看答案及解析
-
不属于四种基本反应类型的氧化还原反应是
A. 2KMnO4
K2MnO4+MnO2+O2↑ B. 2Na+Cl2
2NaCl
C. Fe+CuSO4===Cu+FeSO4 D. Fe2O3+3CO
2Fe+3CO2
难度: 简单查看答案及解析
-
已知常温下,在溶液中发生如下反应:
①16H++10Z-+2XO4—=2X2++5Z2+8H2O
②2A2++B2=2A3++2B-
③2B-+Z2=B2+2Z-
由此推断下列说法错误的是( )
A. 反应Z2+2A2+=2A3++2Z-可以进行
B. Z元素在反应③中被还原,在反应①中被氧化
C. 氧化性由强到弱的顺序是XO4—、Z2、B2、A3+
D. 还原性由强到弱的顺序是Z-、B-、A2+、X2+
难度: 中等查看答案及解析
-
根据下列电离方程式判断,下列分组正确的是( )
①H2SO4=2H++SO42—、②Ba(OH)2=Ba2++2OH-、③KAl(SO4)2=K++Al3++2 SO42—、④NaHSO4=Na++H++SO42—
A. 属于酸的是①④ B. 属于碱的是②
C. 属于盐的只有③ D. 属于盐的只有④
难度: 简单查看答案及解析
-
已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )
A. CO32—、Cl﹣ B. NO3—、Cl﹣
C. NO3—、SO42— D. OH﹣、NO3—
难度: 中等查看答案及解析
-
某无色溶液中,可大量共存的离子组是( )
A. Na+、HCO3-、SO42-、Br-
B. Cu2+、NO3-、Cl-、SO42-
C. H+、Cl-、K+、CO32-
D. K+、Mg2+、SO42-、OH-
难度: 简单查看答案及解析
-
符合如图中阴影部分的物质是( )

A. 碳酸氢钠 B. 碱式碳酸铜
C. 氯化钠 D. 碳酸钠
难度: 简单查看答案及解析
-
下列关于合金的叙述中正确的是( )
A. 合金是由两种或多种金属熔合而成的
B. 日常生活中用到的5角硬币属于铜合金
C. 合金在任何情况下都比单一金属性能优良
D. 钢不属于合金
难度: 中等查看答案及解析
-
0.10 mol镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
A. 3.2 g B. 4.0 g C. 4.2 g D. 4.6 g
难度: 中等查看答案及解析
-
使溶液中的AlO2—完全转化成Al(OH)3,应选择的试剂最好是( )
A. 稀H2SO4 B. 盐酸 C. CO2 D. 氨水
难度: 中等查看答案及解析
-
节目焰火表演,精彩纷呈,让人惊叹不已。下列关于焰色反应的说法正确的是( )
A. 金属及其化合物在灼烧时其火焰都具有颜色
B. 焰色反应都应透过蓝色钴玻璃观察
C. 氯化钠与碳酸钠灼烧时火焰颜色相同
D. 焰色反应呈现黄色火焰时,灼烧的物质一定为钠或钠盐
难度: 简单查看答案及解析
-
过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后排出气体,残留的物质应是
A. Na2O和Na2O2 B. Na2O2和Na2CO3 C. Na2CO3 D. Na2O
难度: 中等查看答案及解析
-
下列关于金属性质的叙述中正确的是 ( )
A. 钠与氧气反应时,产物是由氧气的用量决定的
B. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
C. 金属与非金属单质反应时,一定是金属被氧化
D. 铁丝不论在空气中还是纯氧中都不会燃烧
难度: 简单查看答案及解析
-
在两个烧杯中各加入相同体积且浓度均为3 mol·L-1的硫酸溶液,随后分别置于天平左右两个托盘上,调节天平使之平衡,此时向两烧杯中分别加入10.8 g镁与铝,反应完毕后天平两端将会( )
A. 放铝的一端托盘上升 B. 放镁的一端托盘上升
C. 仍保持平衡 D. 无法确定
难度: 中等查看答案及解析
-
某金属与氯气反应生成的化合物中,其质量比为1∶1.9,原子个数比为1∶3,则金属的相对原子质量为
A. 27 B. 56 C. 23 D. 64
难度: 简单查看答案及解析
-
实验室制取下列气体时,其气体发生装置相同的一组是( )
A. 氨气和氯气 B. 氨气和氯化氢
C. 氨气和二氧化碳 D. 氨气和氧气
难度: 中等查看答案及解析
-
实验室制取氧气的试管壁上黏附有少量MnO2,除去黏附的MnO2可选用的试剂是
A. 蒸馏水 B. KOH溶液 C. 稀盐酸 D. 浓盐酸
难度: 简单查看答案及解析
-
下列关于硅及其化合物的叙述正确的是( )
A. 硅晶体可用于制造光导纤维
B. 陶瓷、玻璃、水泥都是硅酸盐产品
C. 二氧化硅在电子工业中是重要的半导体材料
D. 二氧化硅与氢氟酸和氢氧化钠均能反应,属于两性氧化物
难度: 中等查看答案及解析
-
将氯气制成漂白粉的主要目的是( )
①使它转变成较易溶于水的物质
②转变成较稳定、便于贮存的物质
③提高氯的质量分数
④提高漂白能力
A. ①② B. ②③④ C. ②③ D. ②
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. Na2SiO3是硅酸盐,但不能溶于水
B. 电影银幕用水玻璃浸泡,主要是为了防腐
C. 建筑工业常用水玻璃作黏合剂
D. 用水玻璃浸泡铁道的木制枕木,主要是为了防火
难度: 中等查看答案及解析