-
下列关于胶体和溶液的说法正确的是( )
A. 制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸
B. 溶液呈电中性,胶体带有电荷
C. 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
D. 胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100nm之间
难度: 简单查看答案及解析
-
东汉成书的《神农本草经》有“石胆化铁为铜”(石胆是硫酸铜)的记载。这一方法开创了人类文明史上湿法冶金的先河。其中涉及的化学反应类型是
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
难度: 简单查看答案及解析
-
进行化学实验时必须要有安全意识,下列做法错误的是
A. 被玻璃割伤手后,先取出伤口里的玻璃片,再用稀过氧化氢溶液擦洗,然后敷药包扎
B. 滴瓶中的滴管用后不用清洗,直接放到滴瓶中
C. 点燃氢气等易燃性气体前,必须检验气体的纯度
D. 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
难度: 简单查看答案及解析
-
下列有关实验操作的叙述错误的是
A. 过滤操作中,漏斗的尖端应该紧靠烧杯内壁
B. 向容量瓶转移液体时,引流用的玻璃棒不可以接触容量瓶内壁
C. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D. 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 标准状况下,22.4L CCl4含有的分子数等于0.lNA
B. 由CO2和O2组成的混合物中共有NA个分子,其体积为22.4L
C. 常温常压下,l mol甲烷分子中所含质子数为10NA
D. 2mol/L的NaCl溶液中钠离子数目为2NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. NaHCO3溶液与盐酸:CO32-+ 2H+=H2O+CO2↑
B. 将少量的铜屑放入硝酸银溶液中:Cu+2Ag+=Cu2++ 2Ag
C. 用醋酸溶液除水垢:2H++ CaCO3=Ca2++ H2O+CO2↑
D. 铁和稀盐酸反应:2Fe+6H+=2Fe3++3 H2↑
难度: 简单查看答案及解析
-
2016年第31届奥运会在巴西里约举行。奥运会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生的化学反应为:5KClO3+6P=3P2O5+5KCl。下列有关该反应的叙述中,错误的是
A. 氯酸钾是氧化剂
B. KCl是还原产物
C. 反应中消耗3mol P时,转移电子的物质的量为15mol
D. 该反应为置换反应
难度: 中等查看答案及解析
-
下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是
A. HCO3-、K+、Na+、SO42- B. Na+、K+、MnO4-、Cl-
C. Mg2+、NH4+、Cl-、NO3- D. Ba2+、K+、S2-、SO42-
难度: 中等查看答案及解析
-
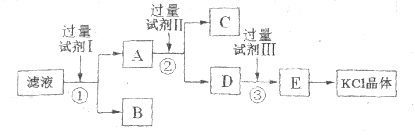
粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。
①加入稍过量的Na2CO3溶液; ②加入稍过量的NaOH溶液:
③加入稍过量的BaCl2溶液: ④过滤; ⑤滴入稀盐酸至无气泡产生。
正确的操作顺序是
A. ①③②④⑤ B. ③②①④⑤ C. ②③①⑤④ D. ③④②①⑤
难度: 中等查看答案及解析
-
两份质量相同的CH4和NH3比较,下列结论错误的是
A. 它们的分子个数之比为17:16
B. 它们的原子个数之比为17:16
C. 它们的氢原子个数之比为17:12
D. 它们所含氢的质量比为17:12
难度: 简单查看答案及解析
-
下列离子检验的方法正确的是
A. 向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl-
B. 向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有SO42-
C. 向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+
D. 向某溶液中加入氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,说明原溶液中有SO42-
难度: 中等查看答案及解析
-
在某罐装车的车身上印有如下警示标记,则车内装的物品不可能为

A. 酒精 B. 浓硫酸 C. 浓HNO3 D. 浓氨水
难度: 简单查看答案及解析
-
下列四种化学实验操作名称从左到右分别是( )
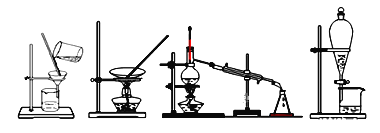
A. 过滤、蒸馏、蒸发、萃取 B. 过滤、蒸发、蒸馏、萃取
C. 蒸发、蒸馏、过滤、萃取 D. 萃取、蒸馏、蒸发、过滤
难度: 简单查看答案及解析
-
下列溶液中溶质的物质的量浓度为1mol/L的是
A. 将58.5g NaCl溶解于1L水中 B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将2L 5mol/L的浓盐酸与8L水混合 D. 将l0g NaOH溶解于水中配成250mL溶液
难度: 简单查看答案及解析
-
某溶液中含有0.2mol/L的NH4+、0.25mol/L的Fe2+、0.4 mol/L的Cl-及一定量的SO42-,则SO42-的物质的量浓度为
A. 0.15mol/L B. 0.3mol/L C. 0.5mol/L D. 0.1mol/L
难度: 简单查看答案及解析
-
分类是化学学习与研究的常用方法,下列分类正确的是
①硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物;
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质;
③金属氧化物都属于碱性氧化物;
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
⑥非金属氧化物都属于酸性氧化物;
⑦根据溶液导电能力强弱,将电解质分为强电解质、弱电解质.
A. 只有②④⑥⑦ B. 只有①③⑤⑦ C. 只有③④⑥ D. 只有①②⑤
难度: 中等查看答案及解析
-
下列属于电解质并能导电的物质是
A. 蔗糖 B. KNO3溶液 C. Fe D. 熔融的Na2O
难度: 中等查看答案及解析
-
常温下,相同物质的量浓度的下列溶液,导电能力最强的是 ( )
A.盐酸 B.氨水 C.醋酸 D.碳酸钠
难度: 简单查看答案及解析
-
人们对物质性质的研究是一种科学探究的过程,这种研究过程的科学组合应该是
A. 预测物质的性质→观察物质的外观→实验和观察→解释和结论
B. 观察物质的外观→预测物质的性质→解释和结论 →实验和观察
C. 预测物质的性质→观察物质的外观→解释和结论 →实验和观察
D. 观察物质的外观→预测物质的性质→实验和观察→解释和结论
难度: 简单查看答案及解析
-
氯化钯可用来检测有毒气体CO,发生反应的化学方程式为CO+PdCl2+H2O=CO2+Pd↓+2HCl。下列关于该反应的说法中正确的是
A. CO2为还原产物 B. CO表现还原性
C. PdCl2被氧化 D. 当生成22.4LCO2时,转移电子的物质的量为2mol
难度: 中等查看答案及解析
-
从氮元素的化合价判断,下列物质只能具有还原性的是
A. NH3 B. NO C. NO2 D. HNO3
难度: 简单查看答案及解析
-
根据反应(1)2Fe3++Cu=Cu2++2Fe2+
(2)2Fe2++Cl2=2Fe3++2Cl-
(3)HClO+H++Cl-=H2O+Cl2,可以判断出各粒子的氧化性由强到弱顺序正确的是
A. HClO>Cl2>Fe3+>Cu2+
B. Cl2>HClO>Fe3+>Cu2+
C. Cl2>Fe3+>HClO>Cu2+
D. HClO>Cl2>Cu2+>Fe3+
难度: 中等查看答案及解析
-
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
,
,
,
。如果分别用等物质的量的这些物质氧化足量的KI, 得到
最多的是
A.
B.
C.
D.
难度: 困难查看答案及解析
-
已知
在酸性溶液中易被还原成
,且
、
、
、
的氧化性依次减弱。下列叙述中,正确的是
A.
通入
溶液中,可存在反应3
+6
====2
+4
B. 每1 mol
在酸性溶液中被氧化生成
时转移2 mol
C.
溶液能将KI溶液中的I
氧化
D. I
具有较强的氧化性,可以将
氧化成
难度: 困难查看答案及解析
-
某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+。取该溶液200mL加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧沉淀,得到1.6g固体。向上述滤液中加足量BaCl2溶液,得到4.66g沉淀,且沉淀不与盐酸反应。由此可知原溶液中
A. 存在3种离子 B. Cl-一定存在,且c(Cl-)=0.2mol/L
C. SO42-、NH4+、Fe3+ 一定存在,Cl-不存在 D. CO32-可能存在
难度: 中等查看答案及解析
 无明显现象
无明显现象 无明显现象。
无明显现象。