-
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人而是救人。那么,这种做法的化学原理是
A. 胶体的电泳 B. 血液的氧化还原反应
C. 血液中发生复分解反应 D. 胶体的聚沉
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 物质的量是研究物质所含微粒集体的多少,单位为mol
B. 物质的量把微观粒子数目与宏观物质的质量联系起来
C. 1mol NaCl 晶体中含有NA个NaCl分子
D. 0.012kg C-12中所含的原子数为阿佛加德罗常数,NA近似为6.02x1023mol-1
难度: 简单查看答案及解析
-
下列关于物质分离提纯的描述不正确的是( )
A. 物质分离或提纯方法的选择依据是混合物的状态和性质
B. KCl和MnO2混合物分离步骤为:溶于水、过滤、洗涤、干燥、蒸发、结晶
C. 从碘水中萃取I2,可选择用苯、乙醇、四氯化碳作萃取剂
D. NaCl中混有少量KNO3杂质,分离步骤为溶于水、蒸发结晶、趁热过滤、洗涤、干燥
难度: 简单查看答案及解析
-
下列实验操作正确的是( )
A. 用蒸发皿蒸发溶液时,应垫石棉网
B. 使用分液漏斗前无需检漏
C. 萃取时,分液漏斗倒转,不断振荡,并及时放气
D. 分液时,上层液体等下层液放出后,再继续放出
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 物质的量浓度是指单位体积溶剂中所含溶质的物质的量
B. 容量瓶不能作反应的容器,但可以储存配好的溶液
C. 容量瓶使用前要检漏,方法是加入一定量水倒转过来不漏即可
D. 定容时,往容量瓶中注入蒸馏水,直到液面接近容量瓶的刻度线1—2厘米处时,改用胶头滴管滴加,直到溶液凹液面正好与刻度线相切
难度: 简单查看答案及解析
-
氯化钠中含有少量硫酸镁、氯化钙和泥沙等杂质,需进行下列项操作:①加水溶解 ② 加入过量的氯化钡溶液 ③加热蒸发得到晶体 ④加入过量碳酸钠和氢氧化钠 ⑤ 加入适量的盐酸⑥过滤 下列操作顺序正确的是( )
A. ①②④③⑥⑤ B. ①②④⑥⑤③
C. ①④⑤⑥③② D. ①④②⑤⑥③
难度: 简单查看答案及解析
-
下列变化是氧化还原反应的是( )
A. NH4HCO3
NH3↑+H2O+CO2↑ B. 2FeSO4
Fe2O3+SO2↑+SO3↑
C. 2O3
3O2 D. CaO+CO2 = CaCO3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. HCl溶于水后形成水合氢离子和水合氯离子
B. HCl溶于水或融熔状态下均能导电
C. 盐酸是电解质,酒精为非电解质
D. 盐酸属于无氧酸,H2SO4溶液属于含氧酸
难度: 中等查看答案及解析
-
在相同温度和压强下,容器A中的臭氧(O3)和容器B中的乙炔气(C2H2)所含的原子个数相同,则A、B两容器中气体的体积之比是( )
A. 4:3 B. 3:4 C. 1:1 D. 2:3
难度: 中等查看答案及解析
-
下列各组离子中,一定能够大量共存的是( )
A. Na+、HS-、Cl-、OH- B. Fe2+、Na+、Cl-、SO42-
C. K+、Fe3+、Ca2+、CO32- D. Mg2+、NH4+、Cl-、OH-
难度: 中等查看答案及解析
-
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是( )
A. 表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B. “出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C. 最后变成碳酸钠粉末
D. 该过程中所有化学反应均为氧化还原反应
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.15 mol CuO与足量的 H2反应,消耗的氢原子数与标准状况下3.36LH2O含的氢原子数相等
B. 常温下,0.1 mol·L-1NH4NO3溶液中含有的氮原子数是 0.2NA
C. 常温常压下,3.2 g O2和 3.2 g O3所含氧原子数都是 0.2NA
D. 2.24 L CO 和 4.4gCO2的混合气体的平均摩尔质量为36g/mol
难度: 中等查看答案及解析
-
下列反应的现象描述与离子方程式都正确的是( )
A. 铝片插入硝酸银溶液中,有银析出:Al+Ag+=Al3++Ag
B. 氢氧化钡溶液与稀硫酸反应,有白色沉淀生成:Ba2++SO42-=BaSO4↓
C. 氢氧化铜加到盐酸中,无明显现象:Cu(OH)2+2H+=Cu2++2H2O
D. 碳酸钡中加入稀盐酸,固体溶解,生成无色无味气体:2H++ BaCO3=Ba2++ H2O + CO2↑
难度: 中等查看答案及解析
-
在反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中( )
A. 氧化产物与还原产物粒子个数比是2∶5
B. 被氧化的HCl占参加反应HCl总分子数的5/8
C. KMnO4只有一部分发生还原反应
D. KMnO4与HCl恰好分别完全被还原和被氧化
难度: 中等查看答案及解析
-
等物质的量的 N2、O2、CO2混合气体通过 Na2O2后(已知2Na2O2+2CO2=2Na2CO3+02,其它物质不与Na2O2反应),体积变为原体积的8/9 (同温同压),此时混合气体中 N2、O2、CO2的物质的量之比为( )
A. 3∶4∶1 B. 3∶3∶2 C. 6∶7∶3 D. 6∶9∶1
难度: 中等查看答案及解析
-
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
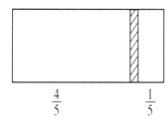
A. 右边CO与CO2分子数之比为3:1
B. 右侧CO的质量为14g
C. 右侧气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为6: 5
难度: 中等查看答案及解析

