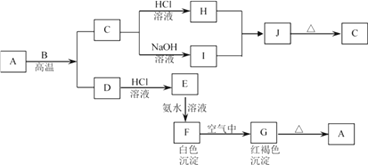
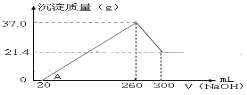
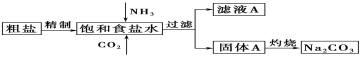
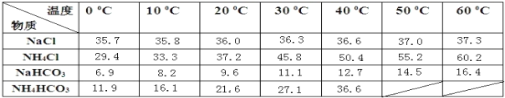
-
有关NaHCO3和Na2CO3的性质,以下叙述正确的是
A. 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积大
B. 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C. 将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3 溶液中产生白色沉淀
D. 同物质的量浓度的两种溶液,Na2CO3溶液的碱性弱于NaHCO3溶液
难度: 中等查看答案及解析
-
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是①向饱和碳酸钠溶液中通入过量的CO2;②向NaAlO2溶液中逐滴加入过量的稀盐酸;③向AlCl3溶液中逐滴加入过量的稀氢氧化钠溶液;④向硅酸钠溶液中逐滴加入过量的盐酸;⑤向Fe(OH)3胶体中滴入稀盐酸至过量
A. ①② B. ④⑤ C. ①④ D. ①④⑤
难度: 中等查看答案及解析
-
将钠、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是( )
A. 1∶2∶3 B. 6∶3∶2 C. 3∶1∶1 D. 1∶1∶1
难度: 困难查看答案及解析
-
将适量的CH4、O2、Na2O2密封于一密闭容器中,在150℃时,不断地用电火花引燃混合气体,反应彻底结束后,容器内压强为0,且残留固体溶于水无气体产生。则CH4、O2、Na2O2三种物质的物质的量之比为( )
A. 2:1:3 B. 2:3:1 C. 2:6:1 D. 2:1:6
难度: 困难查看答案及解析
-
将 3.9 g 镁铝合金投入到 500 mL 2 mol/L 的盐酸中,金属完全溶解,再加入 4mol/L 的NaOH 溶液,若要生成的沉淀最多,加入的这种 NaOH 溶液的体积为
A. 125mL B. 200mL C. 250mL D. 560mL
难度: 简单查看答案及解析
-
下列性质中不是所有金属共有的是
A.不透明 B.易与氧气反应 C.易导热 D.易导电
难度: 中等查看答案及解析
-
下列物质与其俗名匹配且相关叙述合理的是
A. 磁性氧化铁:四氧化三铁,为黑色晶体
B. 铁红:氧化亚铁,可用作红色油漆的颜料
C. 双氧水:过氧化氢,受热稳定、易溶于水
D. 苏打: 碳酸氢钠,可用于治疗胃酸过多
难度: 中等查看答案及解析
-
铝制品在空气中比铁制品更不易被锈蚀,原因是
A. 铝的金属活动性比铁弱
B. 铝的密度比铁的密度小
C. 铝在空气中易与氧气反应形成一层致密的氧化膜
D. 铝常温不能跟氧气发生化学反应
难度: 中等查看答案及解析
-
将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 含最高价元素的化合物,一定具有强氧化性
B. 阳离子只有氧化性,阴离子只有还原性
C. 失电子越多,还原性越强
D. 强氧化剂与强还原剂不一定能发生氧化还原反应
难度: 中等查看答案及解析
-
以下各化合物能通过对应元素单质经化合反应制取的是
A. Fe(OH)3 B. FeCl2 C. FeS D. Fe2S3
难度: 简单查看答案及解析
-
用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:
①Fe
H2
Cu ②CuO
CuSO4
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是
A. ①多 B. ②多 C. 相等 D. 无法判断
难度: 困难查看答案及解析
-
下列变化不可能通过一步实验直接完成的是( )
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
难度: 简单查看答案及解析
-
下列关于焰色反应的说法不正确的是
A. 金属单质无焰色反应
B. 很多金属或它们的化合物灼烧时有焰色反应
C. 透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色
D. 每次焰色反应实验后都要将铂丝用稀盐酸洗净并灼烧
难度: 简单查看答案及解析
-
已知在酸性溶液中,下列物质氧化KI时自身发生如下变化:Fe3+ →Fe2+;MnO4-→ Mn2+;Cl2 → 2Cl-;HNO3 → NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最少的是
A. Fe3+ B. MnO4- C. Cl2 D. HNO3
难度: 中等查看答案及解析
-
某溶液能溶解Al(OH)3,则此溶液中可能大量共存的离子组是
A. Fe3+、NH4+、OH-、Cl- B. K+、Na+、SO42-、HCO3-
C. Na+、Ba2+、Cl-、NO3- D. Al3+、Na+、AlO2-、SO42-
难度: 中等查看答案及解析
-
下列各组溶液,只用胶头滴管和试管,不用其它任何试剂就可以鉴别的是
①A12(SO4)3和KOH ②稀盐酸和稀Na2CO3
③NaA1O2和H2SO4 ④Ba(OH)2和NaHCO3
A.① B.①③ C.①②③ D.①②③④
难度: 中等查看答案及解析
-
Cl2在70℃的NaOH水溶液中能同时发生两个自身氧化还原反应,生成的产物为NaClO、NaClO3、NaCl。反应完全后,测得溶液中NaClO与NaClO3 物质的量之比为5∶1,则溶液中NaCl与NaClO3的物质的量之比为
A. 9∶4 B. 6∶1 C. 10∶1 D. 11∶1
难度: 中等查看答案及解析
-
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1 mol,水的质量为100 g。下列说法正确的是( )

A. Na2O2中阴阳离子数目之比为1∶1
B. 反应①的离子方程式为Na+2H2O===Na++2OH-+H2↑
C. ①、②、③充分反应后所得溶液中溶质的质量分数:①>②>③
D. 反应③转移电子的物质的量为0.1mol
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 过氧化钠加入水中:2O22-+2H2O===4OH-+O2↑
B. 向NaHCO3溶液中滴加NaOH溶液:H++OH-===H2O
C. 将磁性氧化铁溶于盐酸:Fe3O4 +8H+ =3Fe3+ +4H2O
D. 向AlCl3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
难度: 简单查看答案及解析