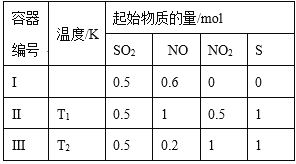
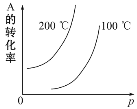
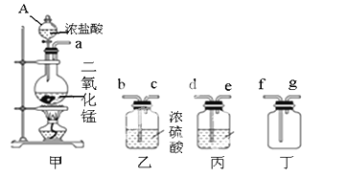
-
下列结论错误的是 ①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4③离子的还原性:S2->Cl->Br->I- ④氧化性: Cl2>S⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si ⑦金属性:Mg<Ca<K
A. 只有① B. ①③ C. ②④⑤⑥⑦ D. ①③⑤
难度: 困难查看答案及解析
-
下列有关滴定操作的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低
C. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高
D. 用未知浓度的盐酸滴定标准的KOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
难度: 简单查看答案及解析
-
已知悬浊液中存在平衡:Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的是
①升高温度,平衡逆向移动
②温度一定时,溶液中c(Ca2+)•c2(OH-)为定值
③向溶液中加入少量碳酸钠粉末能增大c(Ca2+)
④恒温下,向饱和溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入少量NaOH固体,Ca(OH)2 固体质量不变。
⑦向溶液中加入Na2CO3溶液,其中固体质量增加.
A. ①②⑦ B. ①②⑦⑧ C. ③④⑤⑦ D. ①③⑦⑧
难度: 中等查看答案及解析
-
A2+B2=2AB的反应历程可以看作如下(△H表示该过程的能量变化):
Ⅰ.A2=A+A △H1
Ⅱ.B2=B+B △H2
Ⅲ.A+B=AB △H3
则下列说法中正确的是
A. 当△H3+(△H1+△H2)>0时,该反应是吸热反应
B. 当2△H3+(△H1+△H2)>0时,该反应是放热反应
C. 当2△H3+(△H1+△H2)<0时,该反应是放热反应
D. 当△H3+(△H1+△H2)<0时,该反应是吸热反应
难度: 中等查看答案及解析
-
下列影响因素中,既能改变化学反应速率,又能改变化学平衡常数的是
A. 催化剂 B. 浓度 C. 温度 D. 固体表面积大小
难度: 简单查看答案及解析
-
在不同情况下测得A(g)+3B(g)
2C(g)+ 2D(s)的下列反应速率,其中反应速率最大的是
A. υ(D)=0.01 mol•L-1•s-1 B. υ(C)=0.010 mol•L-1•s-1
C. υ(B)=0.6 mol•L-1•min-1 D. υ(A)=0.2mol•L-1•min-1
难度: 中等查看答案及解析
-
下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l)
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
难度: 困难查看答案及解析
-
通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确的是
①C(s) + H2O(g)==CO(g) + H2 (g) ΔH1 = akJ·mol−1
②CO(g) + H2O(g)==CO2(g) + H2 (g) ΔH2 = bkJ·mol−1
③CO2 (g) + 3H2 (g)==CH3OH(g) + H2O(g) ΔH3 = ckJ·mol−1
④2CH3OH(g)==CH3OCH3 (g) + H2O(g) ΔH4 = dkJ·mol−1
A. 反应①、②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==
CH3OCH3 (g) +
H2O(l)的ΔH =
kJ·mol−1
D. 反应2CO(g) + 4H2 (g)==CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol−1
难度: 简单查看答案及解析
-
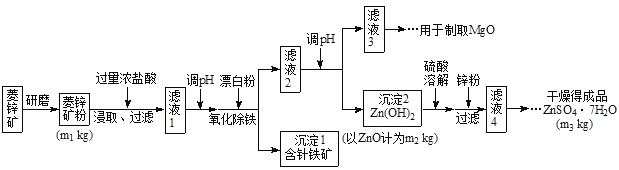
镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )
A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阴极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
难度: 困难查看答案及解析
-
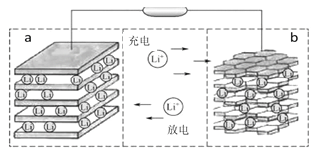
一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。
下列说法不正确的是
A. 放电时,Mg(液)层的质量减小
B. 放电时.正极反应为:Mg2++2e-=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1- 有向下层移动的趋势
难度: 中等查看答案及解析
-
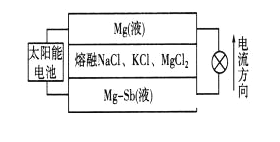
2017年9月亮相、2018年上市的奔驰燃料电池汽车GLCF-Cell,其电池采用的是质子交换膜燃料电池,工作原理如下图所示,则下列叙述正确的是
A. H2 作正极
B. 正极反应式为O2+4OH-+4e-=2H2O
C. 导电微粒在电池内部由负极定向移动至正极
D. 总反应式为2H2+O2
2H2O
难度: 中等查看答案及解析
-
已知:25 C 时,Ksp[Zn(OH)2]= 1.0×10-18, Ka(HCOOH)= 1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解平衡常数为 1.0×10-10
B. 向 Zn(OH)2 悬浊液中加少量 HCOOH,溶液中 c(Zn2+)增大
C. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6 mol/L
D. Zn(OH)2(s) +2HCOOH(aq)
Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100
难度: 困难查看答案及解析
-
常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
难度: 困难查看答案及解析
-
室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,
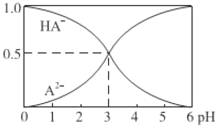
下列说法不正确的是
A. H2A的电离方程式为:H2A==H++HA- HA-
A2-+H+
B. 室温下,电离平衡HA-
A2-+H+的平衡常数Ka=10-3。
C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
难度: 困难查看答案及解析
-
柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
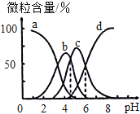
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C. Na2HR溶液中HR2-的水解程度大于电离程度
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体
HX放出的氢气多且反应速率快
酸的强弱:HX<HY
B
向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4
先生成白色沉淀,后生成黑色沉淀
溶度积(Ksp):ZnS>CuS
C
向FeCl3和KSCN混合溶液中,加入少量KCl的固体
溶液颜色变浅
FeCl3+3KSCN
Fe(SCN)3 +3KCl平衡向逆反应方向移动
D
常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH
pH:NaA>NaB
常温下酸性:HA﹤HB
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在密闭容器中进行以下可逆反应:A(g)+B(g)
C(g)+2D(?),在不同的条件下C的百分含量的变化情况如右图,则该反应描述正确的是
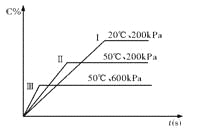
A. 正反应放热,D是固体
B. 正反应放热,D是气体
C. 正反应吸热,D是气体
D. 正反应放热,D是固体或气体
难度: 中等查看答案及解析
-
向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是
A. 向电解液中加入稀硫酸,有利于Cl-的去除
B. 溶液pH越大,Ksp(CuCl)增大
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. 1/2 Cu(s)+ 1/2 Cu2+(aq)+Cl—(aq)
CuCl(s) ΔH=(a+2b) kJ·mol-1
难度: 困难查看答案及解析
-
常温下,HX溶液、HY溶液、HY和NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是
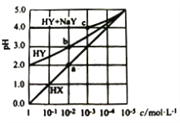
A. HX、HY均为一元强酸
B. 溶液中水的电离程度:a = b < c
C. 常温下,HY的电离常数Ka约为1.0×10-4
D. c点溶液:c(Na+)>c(Y-)>c(HY) >c(H+)>c(OH-)
难度: 困难查看答案及解析