-
工业制硝酸的其中一步反应为氨的氧化,反应方程式为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-1025kJ/mol
氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
A.反应处于平衡状态时,c(NH3)•c(O2)=c(NO)•c(H2O)
B.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.寻找合适的催化剂是加快反应速率并提高NO产率的有效措施难度: 中等查看答案及解析
-
喷墨打印机墨汁的pH为7.5~9.0.当墨汁喷在打印纸上时,酸性物质与碱性物质作用生成不溶于水的固体.下列有关喷墨打印机的墨汁和打印纸的叙述①墨汁偏碱性 ②墨汁偏酸性 ③打印纸偏碱性 ④打印纸偏酸性.正确的是( )
A.①③
B.②④
C.①④
D.②③难度: 中等查看答案及解析
-
下列有关化学反应原理的说法正确的是( )
A.纯银器表面在空气中因发生化学腐蚀生成Ag2O而变暗
B.用热的纯碱液洗涤油污主要是因为温度升高化学反应速率加快
C.将钢闸门与电源的正极相连,是采用了外加电流的阴极保护法
D.洗涤银镜反应的试管用氯化铁溶液比硫酸铁溶液效果好,其原因是氯化铁溶液会使反应Fe3++Ag═Fe2++Ag+生成的c(Ag+)降低的程度大,平衡向右移动难度: 中等查看答案及解析
-
下列各选项所述的两个量,前者一定大于后者的是( )
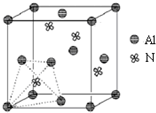
①Al原子和N原子的未成对电子数;②Ag+、Cu2+与NH3形成配合物时的配位数;③NaCl的晶格能与MgO的晶格能;④F元素和O元素的电负性;⑤N元素和O元素的第一电离能;⑥H原子和H+离子的半径.
A.①⑤
B.①②④
C.④⑤⑥
D.①⑤⑥难度: 中等查看答案及解析
-
一定温度下,在固定体积的密闭容器中发生反应:2SO2(g)+O2(g)═2SO3(g).若c(SO3)由0增加到0.06mol•L-1时,需要15s,那么c(SO3) 由0.06mol•L-1增加到0.10mol•L-1时,所需反应时间为( )
A.大于10 s
B.等于10 s
C.小于10 s
D.等于5s难度: 中等查看答案及解析
-
X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中原子半径最大的元素(除稀有气体元素).下列说法正确的是( )
A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3
B.Z和M组成的化合物为离子化合物,它与盐酸反应可以生成两种盐
C.X、Y、Z元素的气态氢化物中,Y的沸点最高
D.四种元素简单离子的半径由大到小依次为Y>M>X>Z难度: 中等查看答案及解析
-
将等质量且过量的两份锌粉a、b中分别加入相同体积、相同物质的量浓度的稀硫酸,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是( )
A.
B.
C.
D.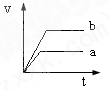
难度: 中等查看答案及解析
-
在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻.甲、丁的原子序数之和等于丙的原子序数;这四种元素原子的价电子数之和为20,下列判断中正确的是( )
A.原子半径:丙>丁>甲>乙
B.甲、乙、丙三种元素位于周期表的同一周期
C.最高价氧化物对应水化物的酸性:乙>甲
D.气态氢化物的稳定性:甲>丙难度: 中等查看答案及解析
-
下列实验操作能达到实验目的是( )
编号 实验目的 实验操作 A 测定溶液的pH值 用广泛pH试纸测得溶液的pH为2.3 B 证明氯化铁与碘化钾溶液发生氧化还原反应 将两根用导线相连的铁棒分别插入用盐桥相连的氯化铁、碘化钾溶液中 C 排除碱式滴定管尖嘴部分的气泡 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 D 准确测定体积25mL浓度约为0.15mol•L-1 HCl溶液的浓度 用25.00mL碱式滴定管和0.1000mol•L-1 NaOH溶液滴定
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列各组离子,在指定的环境中能大量共存的是( )
A.在酸性溶液中:Na+、K+、MnO4-、S2O32-
B.在中性溶液中:Al3+、K+、SO42-、HCO3-
C.25℃,pH=0的溶液中:Al3+、NH4+、NO3-、Fe2+
D.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、NO3-难度: 中等查看答案及解析
-
在一定条件下,反应xA+yB═zC△H达到平衡状态,下列说法不正确的是( )
A.若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x+y>z
B.若C是气体,且x+y=z,增大压强时,平衡发生移动,则平衡向正反应方向移动
C.若B、C是气体,其他条件不变,增大A的量,平衡不移动,则A不是气态物质
D.若加热后C的质量分数减少,则该反应的焓变△H>0难度: 中等查看答案及解析
-
银锌纽扣电池由锌粉作负极、氧化银作正极和氢氧化钾溶液构成.电池工作时的反应原理为:Zn+Ag2O+H2O═Zn(OH)2+2Ag.则下列说法正确的是( )
A.电池工作时,负极附近溶液的pH减小
B.电池工作时,溶液中OH-向正极移动
C.电池工作一段时间后,溶液的pH不变
D.电池工作过程中,Ag2O发生还原反应难度: 中等查看答案及解析
-
在某密闭容器中投入X、Y进行如下反应:X(g)+2Y(g)
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
A.1<<3
B.<
<
C.3<<4
D.<
<
难度: 中等查看答案及解析
-
常温下,下列各溶液的叙述中正确的是( )
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性c(Ac-)>c(Cl-)>c(H+)>c(HAc)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)=c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)]难度: 中等查看答案及解析