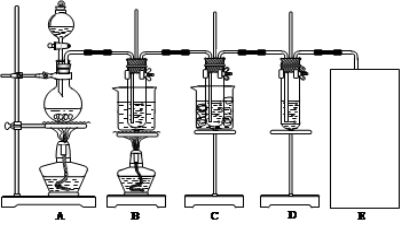
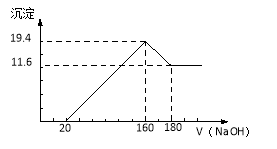
-
雷雨天闪电时空气中有臭氧(O3)生成。下列说法正确的是
A.O2和O3互为同位素
B.O2和O3相互转化属于物理变化
C.在相同的温度和压强下,等体积的O2和O3含有相同的分子数
D.等物质的量的O2和O3含有相同的质子数
难度: 中等查看答案及解析
-
在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的是
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
下列现象或新技术应用中,不涉及胶体性质的是( )
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
C.清晨,茂密的树林中,常常可以看到从枝叶间透过一道道光柱
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
难度: 简单查看答案及解析
-
下列各组物质,前者属于电解质,后者属于非电解质的是
A. NaCl晶体、BaSO4 B. 铜、二氧化硫
C. 熔融的KNO3、酒精 D. 液态的醋酸、硫酸溶液
难度: 中等查看答案及解析
-
在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-离子中的3种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是
A.Cu2+、H+、Cl- B.CO32-、OH-、Cl-
C.K+、H+、Cl- D.K+、OH-、CO32-
难度: 中等查看答案及解析
-
是常规核裂变产物之一,可以通过测定大气或水中
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的叙述中错误的是
A.
的化学性质与
相同 B.
的原子序数为53
C.
的原子核外电子数为78 D.
的原子核内中子数多于质子数
难度: 简单查看答案及解析
-
下列关于碱金属元素的原子结构和性质的叙述不正确的是
A.碱金属原子最外层都只有1个电子,在化学反应中容易失去
B.碱金属单质都是强还原剂
C.碱金属单质都能在氧气中燃烧生成过氧化物
D.碱金属单质都能与水反应生成强碱
难度: 简单查看答案及解析
-
某金属氯化物MCl2 40.5g,含有0.6molCl-,则金属M的摩尔质量为( )
A.135 B.135g/mol C.64 D.64 g/mol
难度: 中等查看答案及解析
-
在下列变化①大气固氮(闪电时空气中N2、O2化合成NO)、②硝酸银分解(生成单质银、O2、NO2)、③实验室制取氨气(氯化铵固体与消石灰加热)中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A. ①②③ B. ②①③ C. ③②① D. ③①②
难度: 中等查看答案及解析
-
宋代著名法医学家宋慈的《洗冤集录》中有一银针验毒的记载,“银针验毒”的原理是4Ag + 2H2S + O2 = 2X + 2H2O,下列说法正确的是
A.X的化学式为AgS B.银针验毒时,空气中氧气失去电子
C.反应中Ag和H2S均是还原剂 D.每生成1mo1X,反应转移2mo1e-
难度: 中等查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下, NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
难度: 简单查看答案及解析
-
A和B是前三周期的元素,它们的离子A+和B2+具有相同的核外电子层结构,下列说法错误的是
A. 主族序数:A< B B. 原子序数:A< B
C. 离子半径:A+>B2+ D. 质量数:A>B
难度: 中等查看答案及解析
-
下列实验操作或方法中,正确的是
A.
 将NaOH溶液储存在玻璃滴瓶中
将NaOH溶液储存在玻璃滴瓶中B.
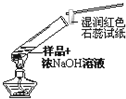 检验试液中 NH4+的存在
检验试液中 NH4+的存在C.
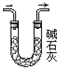 干燥SO2气体
干燥SO2气体D.
 收集HCl气体
收集HCl气体难度: 中等查看答案及解析
-
下列各组物质中,X是主体物质,Y是少量杂质,Z是要除去杂质而加入的试剂,其中正确的组别是
X
Y
Z
A
FeCl2溶液
FeCl3
KSCN溶液
B
FeCl2溶液
CuCl2
Zn粉
C
Fe2(SO4)3溶液
FeSO4
C12
D
Fe粉
A1粉
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。已知Y原子的最外层电子数是次外层的3倍。下列叙述正确的是
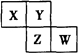
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. Y单质的沸点比Z单质的沸点高
D. W单质跟水反应形成的溶液具有漂白性
难度: 中等查看答案及解析
-
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入一定量的Na2CO3和NaHCO3,A、B中分别装有足量的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是

A. 侧管中装入Na2CO3的气球膨胀速率大
B. 若加入等质量的Na2CO3和NaHCO3 ,最终两气球体积不同
C. 最终两试管中Na+、Cl-的物质的量一定相同
D. 热稳定性:Na2CO3 < NaHCO3
难度: 中等查看答案及解析