-
“玉兔”号月球车用23894Pu作为热源材料。下列关于23894Pu的说法正确的是
A. 23894Pu与23892U互为同位素
B. 23894Pu与23994Pu互为同素异形体
C. 23894Pu与23994Pu互为同位素
D. 23894Pu与23892U具有完全相同的化学性质
难度: 简单查看答案及解析
-
W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,下列说法正确的是
W
X
Y
Z
A.X、Y、Z中最简单氢化物稳定性最差的是Y
B.X元素形成的单核阴离子还原性强于Y
C.Z元素氧化物对应水化物的酸性强于Y
D.Z元素单质在化学反应中只表现氧化性
难度: 困难查看答案及解析
-
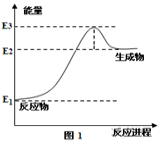
下列表述中正确的是
A.任何能使熵值增大的过程都自发进行
B.已知热化学方程式2SO2(g)+O2(g)
2SO3(g) ΔH=-Q kJ·mol-1(Q>0),则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量
C.人类利用的能源都是通过化学反应获得的
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多
难度: 中等查看答案及解析
-
下列金属冶炼的反应原理中错误的是
A.MgCl2(熔融)
2Mg+Cl2↑
B.Al2O3+3H2=2Al+3H2O
C.Fe3O4+4CO
3Fe+4CO2
D.2HgO
2Hg+O2↑
难度: 简单查看答案及解析
-
在绝热密闭容器中发生反应:aM(g)+bN(g)
cW(g) 达平衡后,测得M气体的浓度为0.5mol/L.若将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L.则下列叙述正确的是
A.反应速率增大 B.平衡向右移动
C.体系温度升高 D.W的质量分数降低
难度: 中等查看答案及解析
-
有关物质结构的下列说法中正确的是
A.石油裂解只破坏极性键
B.氯化钠固体中的离子键在溶于水时被破坏
C.含极性键的共价化合物一定是电解质
D.HF的分子间作用力大于HCl,故HF比HCl更稳定
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是

A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.将氯化铁晶体溶解于浓盐酸中配制氯化铁溶液
B.温度升高,水的电离程度增大
C.氯水中加入碳酸钙,漂白性增强
D.反应H2(g)+I2(g)
2HI(g)达平衡后,缩小反应容器体积,混合气体颜色变深
难度: 简单查看答案及解析
-
分子式C8H8O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有(不考虑立体异构)
A.2种 B.3种 C.4种 D.5种
难度: 困难查看答案及解析
-
下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.铁管上镶嵌锌块,铁管不易被腐蚀
D.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
难度: 中等查看答案及解析
-
已知:H2(g)+Br2(g)=2HBr(g) ;△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质
H2(g)
Br2(g)
HBr(g)
1mol分子中的化学键断裂时
需要吸收的能量/KJ
436
a
369
则上述表格中的a值为
A.404 B.344 C.260 D.200
难度: 中等查看答案及解析
-
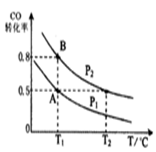
对于可逆反应2AB3(g)
2A(g)+3B2(g) ΔH>0,下列图像不正确的是
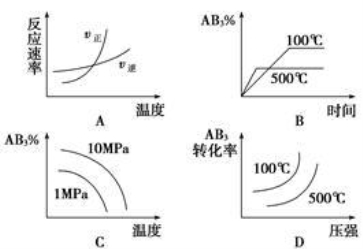
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下,pH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol·L-1
B.温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同
C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1
难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是
A.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+)
D.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑)
难度: 极难查看答案及解析
-
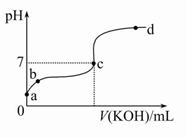
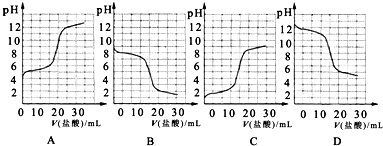
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是
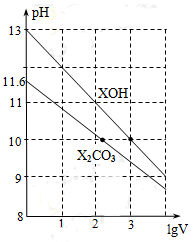
A.XOH是弱碱
B.pH=10的两种溶液中的c(X+):XOH大于X2CO3
C.已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)减小
难度: 极难查看答案及解析
-
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=4×10-10,下列说法不正确的是
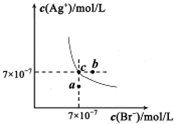
A.在t℃时,AgBr的Ksp为4.9×l0-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)⇌AgBr(s)+Cl-(aq)平衡常数K≈816
难度: 困难查看答案及解析
-
下列有关实验操作、现象及结论的叙述正确的是
A.用钠可以检验某无水酒精中是否含有水
B.除去甲烷中混有的少量乙烯,可以将混合气体通过酸性KMnO4溶液
C.制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸
D.在蔗糖溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明蔗糖没有水解
难度: 中等查看答案及解析
-
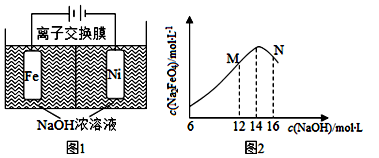
按如图所示的装置进行电解实验。A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量)。通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05 g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为
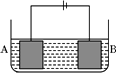
A.4∶1 B.3∶1 C.2∶1 D.1:1
难度: 困难查看答案及解析
-
下列实验事实能达到目的的是
编号
实验内容
实验目的
A
分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大
证明非金属性S>C
B
室温下,用pH试纸测定浓度为0.1 mol·L-1NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
C
向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅
证明Na2CO3溶液中存在水解平衡
D
向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀
证明在相同温度下的Ksp:Mg(OH)2 >Fe(OH)3
难度: 困难查看答案及解析
-
t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为:
。有关该平衡体系的说法正确的是
A.升高温度.平衡常数K一定增大
B.增大压强.W(g)质量分数增加
C.升高温度.若混合气体的平均相对分子质量变小.则正反应是放热反应
D.增大X(g)浓度.平衡向正反应方向移动
难度: 困难查看答案及解析