-
下列各种变化属于原电池反应的是( )
A.红热的铁丝与冷水接触,表面形成蓝黑色保护层
B.镀锌铁皮有划痕,仍然能阻止铁被氧化
C.在空气中铝表面迅速氧化形成保护层
D.锌与稀硫酸反应时,加入醋酸钠溶液反应减慢难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污
B.加热稀醋酸溶液其pH 稍有减小
C.明矾净水
D.浓的硫化钠溶液有臭味难度: 中等查看答案及解析
-
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O⇌HCOO-+H3O+
B.CO2+H2O⇌HCO3-+H+
C.CO32-+H2O⇌HCO3-+OH-
D.HS-+H2O⇌S2-+H3O+难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③实验室可用排饱和食盐水的方法收集氯气
④常温下,将1mL pH=3的醋酸加水稀释至100mL,测得其pH<5
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)⇌K(g)+NaCl(l)
⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深.
A.①②③
B.②⑥
C.①③④⑤
D.②⑤⑥难度: 中等查看答案及解析
-
为了除去MgCl2 酸性溶液中的 Fe3+,可在加热搅拌条件下加入一种试剂,过滤后,在向滤液中加入适量的盐酸,这种试剂是( )
A.NaOH
B.NH3•H2O
C.MgCl2
D.MgCO3难度: 中等查看答案及解析
-
等物质的量浓度的下列溶液中,NH4+的浓度最大的是( )
A.NH4Cl
B.NH4HCO3
C.NH4HSO4
D.NH4NO3难度: 中等查看答案及解析
-
以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极上析出铜的质量是( )
A.8g
B.16g
C.32g
D.64g难度: 中等查看答案及解析
-
下列液体均处于25℃,有关叙述正确的是( )
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.用广泛pH试纸测得0.10 mol•L-1 NH4Cl溶液的pH=5.2
C.pH=2的CH3COOH中c(H+)是pH=1的CH3COOH中c(H+)的2倍
D.AgCl在相同物质的量浓度的CaCl2和HCl溶液中的Ksps相同难度: 中等查看答案及解析
-
下列热化学方程式,正确的是( )
A.4g硫完全燃烧生成SO2,放出37 kJ热量:S(s)+O2(g)=SO2(g);△H=-296kJ/mol
B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-73kJ/mol
C.甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
D.强酸强碱的中和热为-57.3 kJ/mol:Ba(OH)2(aq)+H2SO4(aq)=BaSO4(S)+2H2O(l);△H=-114.6 kJ/mol难度: 中等查看答案及解析
-
当用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸时,下列操作使测定结果(酸的浓度)偏低的是( )
A.碱式滴定管滴至终点,俯视读数
B.碱液移入锥形瓶后,加入10mL蒸馏水
C.碱式滴定管注入碱溶液后,尖嘴有气泡时便开始滴定,滴定后气泡消失
D.碱式滴定管用蒸馏水润洗后,未用标准液润洗难度: 中等查看答案及解析
-
已知室温时,0.1mo1/LCH3COOH在水中有0.1%发生电离,下列叙述正确的是( )
A.该溶液的pH=5
B.升高温度,溶液的pH增大
C.CH3COOH的电离平衡常数约为1×10-6
D.由CH3COOH电离出的c(H+)约为水电离出的c(H+)的106倍难度: 中等查看答案及解析
-
关于下列各装置图的叙述中,不正确的是( )

A.用装置①在铁件上镀铜,则a极为铜,电解质为CuSO4溶液
B.装置②的总反应是:Fe+2Fe3+=3Fe2+
C.装置③中钢闸门应与外接电源的正极相连
D.装置④中的铁钉几乎没被腐蚀难度: 中等查看答案及解析
-
已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mo1•L-1,则生成沉淀所需Na2C2O4溶液的最小起始浓度为( )
A.2.3×10-7mol•L-1
B.4.6×10-7mol•L-1
C.9.2×10-7mol•L-1
D.×10-3mol•L-1
难度: 中等查看答案及解析
-
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是( )
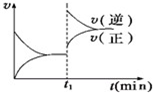
A.2SO2(g)+O2(g)⇌2SO3(g)△H<0
B.4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H<0
C.H2(g)+I2(g)⇌2HI(g)△H>0
D.2A(g)+B(g)⇌2C(g)△H>0难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.滴入甲基橙显红色的溶液中:Na+、NO3ˉ、Iˉ、SO32ˉ
B.水电离出的 c ( H+)=10ˉ12 mol/L 的溶液中:K+、AlO2ˉ、CH3COOˉ、Clˉ
C.=10ˉ12 的溶液中:K+、ClOˉ、S2ˉ、Clˉ
D.c ( Fe 3+ )=0.1 mol/L 的溶液中:K+、Clˉ、SO42ˉ、SCNˉ难度: 中等查看答案及解析
-
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,下列说法正确的是( )

A.该隔膜是阳离子交换膜
B.当电极上析出1.08 g Ag时,电路中转移的电子为0.01 mol
C.Al电极的反应式为:Al-3e-+4OH-=AlO2-+2H2O
D.正极的电极反应式为:O2+2H2O+4e-=4OH-难度: 中等查看答案及解析
-
已知KHSO3溶液呈弱酸性.在0.1mol•L-1KHSO3溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-)
B.c(HSO3-)+c(SO32-)=0.1mol•L-1
C.c(SO32-)<c(H2SO3)
D.c(K+)=c(H2SO3)+c(HSO3-)+c(SO32-)难度: 中等查看答案及解析
-
下列各表述与示意图一致的是( )
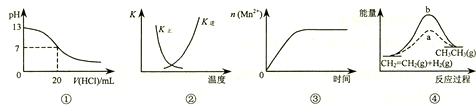
A.图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)⇌2SO3(g)+Q(Q>0)正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时(Mn2+是该反应的催化剂),n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g)+Q(Q>0),使用和未使用催化剂时,反应过程中的能量变化难度: 中等查看答案及解析
-
已知常温下:Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31;Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=5.6×10-12.某溶液中有浓度均为0.0l mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,加入氢氧化钠溶液,当溶液的pH=6时,下列叙述不正确的是( )
A.Fe3+ 已经沉淀完全
B.Cr3+已经沉淀完全
C.Zn2+ 已经开始沉淀
D.Mg2+还没开始沉淀难度: 中等查看答案及解析
-
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)⇌2XY3(g)△H=-92.6kJ•mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
下列叙述不正确的是( )容器
编号起始时各物质物质的量/mol 达平衡时体系能量的变化 X2 Y2 XY3 ① 1 3 放热 23.15kJ ② 0.6 1.8 0.8 Q(Q>0)
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol•L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ难度: 中等查看答案及解析