-
为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是: ( )
A.采用电解水法制取氢气作为新能源
B.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用
C.研制推广以乙醇为燃料的汽车
D.生产、生活中,努力实现资源的循环利用
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.棕红色NO2加压后颜色先变深后变浅
B.钢铁在潮湿的空气中容易生锈
C.实验室可用排饱和食盐水的方法收集氯气
D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
难度: 简单查看答案及解析
-
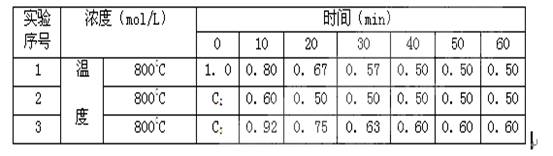
已知反应FeO(s)+C(s)= CO(g)+ Fe(s)的△H>0,(假设△H,△S不随温度变化而变化),下列叙述中正确的是:( )
A. 低温下为自发过程,高温下为非自发过程
B. 高温下为自发过程,低温下为非自发过程
C. 任何温度下为非自发过程
D. 任何温度下为自发过程
难度: 简单查看答案及解析
-
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
下列说法不正确的是:( )
A.由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1
B.等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等
C.若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ
D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA
难度: 简单查看答案及解析
-
把下列4种X溶液,分别加入4个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢地进行反应,若不考虑液体混合后体积的微小变化,其中反应速率最大的是( )
A.20mL3mol·L-1的X溶液 B.20mL2mol·L-1的X溶液
C.10mL4mol·L-1的X溶液 D.10mL2mol·L-1的X溶液
难度: 简单查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c、c、c(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是:( )
A.c:c=1:2 B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等 D.c的取值范围为0.04 mol/L<c<0.14 mol/L
难度: 简单查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是:( )
A.充电时阳极反应:Ni(OH)2 -e- + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH - 向正极移动
难度: 简单查看答案及解析
-
可逆反应:2NO2
2NO+O2在恒温恒容密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2②单位时间内生成n molO2 的同时生成2n mol NO ③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
难度: 简单查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列图象正确的是

难度: 简单查看答案及解析
-
某密闭容器中发生如下反应:X(g) + 3Y(g)
2Z(g) ΔH < 0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
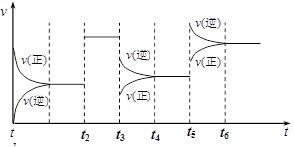
下列说法中正确的是:( )
A.t2时加入了催化剂
B.t3时降低了温度
C.t5时增大了压强
D.该反应最初是从逆反应开始的
难度: 简单查看答案及解析
-
已知298 K时,2SO2(g)+O2(g)
2SO3(g) ΔH=-197 kJ·mol-1。在同一温度和压强下,向某密闭容器中通入2 mol SO2和1 mol O2达到平衡时,反应放出的热量为Q1,向另一相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。下列关系正确的是( )
A.Q2=
B.Q2<
=197 kJ C.Q2<Q1<197 kJ D.Q1=Q2=197 kJ
难度: 简单查看答案及解析
-
将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下:

已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。
金属 电子流动方向 电压/V
A A→Cu +0.78
B Cu→B -0.15
C C→Cu +1.35
D D→Cu +0.30
请依表中数据判断,下列有关说法正确的是( )
①在四种金属中C的还原最强 ②金属B能从硫酸铜溶液中置换出铜
③A、D若形成原电池时,A为正极④A、B形成合金时,将该合金露置在空气中,A先被腐蚀
A①② B②③ C①③ D①④
难度: 简单查看答案及解析
-
某同学为了使反应2HCl + 2Ag2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是( )

难度: 简单查看答案及解析
-
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。

据此,下列叙述正确的是
A 铅笔端作阳极,发生氧化反应
B、铂片端作阴极,发生还原反应
C 铅笔端有少量的氯气产生
D a点是负极,b点是正极
难度: 简单查看答案及解析
-
向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g)
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是 ( )
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
难度: 简单查看答案及解析
-
密闭容器中,反应xA(g)+yB(g)=zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L.下列判断正确的是( )
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
难度: 简单查看答案及解析
-
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)====SnCl2(aq)+H2(g)ΔH1
②Sn(s,灰)+2HCl(aq)====SnCl2(aq)+H2(g)ΔH2
③Sn(灰)
Sn(白)ΔH3=+2.1kJ·mol-1ΔS=7.2J·mol-1·K-1,
下列有关说法正确的是( )
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于18.7℃的环境中,会自行毁坏
难度: 简单查看答案及解析
-
已知在密闭容器里反应:mX(g)+nY(g)
qZ(g)ΔH;反应物Y与反应时间t、温度T、压强p的关系曲线见右图,试通过对此曲线的分析,判断下列描述中正确的是
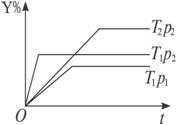
A.T1<T2、p2<p1、m+n>q、ΔH<0
B.T1<T2、p2<p1、m+n>q、ΔH>0
C.T1>T2、p1<p2、m+n<q、ΔH>0
D.T1>T2、p1<p2、m+n<q、ΔH<0
难度: 简单查看答案及解析