-
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A、若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B、由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C、硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D、Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2
难度: 中等查看答案及解析
-
下列关于有机化合物的认识不正确的是
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.石油的分馏和煤的干馏都属于化学变化
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
难度: 简单查看答案及解析
-
下列关于化学观或化学研究方法的叙述中,错误的是( )
A. 为防止水体富营养化,必须控制富含氮、磷污水的排放
B. 在元素周期表的金属和非金属分界线附近寻找半导体材料
C. 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
D. 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应产生的
难度: 简单查看答案及解析
-
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素的内在联系,成为化学史上的重要里程碑之一,下列有关元素周期表的说法正确的是( )
A. 第IA族的元素全部是金属元素 B. 元素周期表有18个纵行,即18个族
C. 短周期是第一、二、三、四周期 D. 元素周期表有七个横行,也是七个周期
难度: 简单查看答案及解析
-
13C-NMR(核磁共振)可用于含碳化合物的结构分析,15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是( )
A. 13C与15N具有相同的中子数 B. 13C与C60是同一种物质
C. 15N与14N互为同位素 D. 15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
根据同分异构体的概念,判断下列物质互为同分异构体的是( )
A. H和D B. CH3-CH2–NO2和H2N–CH2–COOH C. 甲烷和正丁烷 D. 红磷和白磷
难度: 简单查看答案及解析
-
下列物质中,既含有离子键又含有非极性共价键的是( )
A. Na2O2 B. Ba(OH)2 C. HClO D. Ar
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. CO2分子比例模型:
B. S2-的结构示意图:
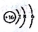
C. 中子数为20的氯原子:
D. HCN分子的结构式:H-C≡N
难度: 中等查看答案及解析
-
已知钍
的原子可发生下列放射性变化:
→
+
A. X的氢氧化物是一种强碱 B. X元素位于第六周期
C. X的碳酸盐难溶于水 D. X的最高化台价为+2价
难度: 中等查看答案及解析
-
下列有关碱金属的说法不正确的是( )
A. 均为IA族元素,最外层均有1个电子
B. 单质的还原性:Li>Na>K>Rb>Cs
C. 碱性:LiOH<NaOH<KOH<RbOH<CsOH
D. 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
难度: 中等查看答案及解析
-
随着卤族元素原子序数递增,下列说法正确的是( )
A. 单质的氧化性逐渐减弱 B. 单质的熔、沸点逐渐降低
C. 单质的密度逐渐降低 D. 气态氢化物的稳定性逐渐增强
难度: 简单查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径: A>B>D>C B. 原子序数: d>c>b>a
C. 离子半径:C2->D->B+>A2+ D. 单质的还原性: A>B>D>C
难度: 中等查看答案及解析
-
下列关于元素周期表的说法中正确的是
A. 过渡元素全部是金属元素
B. 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1
C. 催化剂一般在金属与非金属的分界线处寻找
D. 同一主族元素的原子序数的差不可能为10
难度: 简单查看答案及解析
-
下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
A. A原子最外层电子数比B原子的最外层电子数少
B. 由金属A和金属B构成的原电池,电子由A流向B
C. 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多
D. 常温时,A能从酸中置换出氢,而B不能
难度: 中等查看答案及解析
-
已知元素Se位于第四周期ⅥA族,下列说法不正确的是
A. Se的原子序数为34
B. 单质Se在空气中燃烧可生成SeO3
C. 可形成Na2SeO3、Na2SeO4两种盐
D. H2S比H2Se稳定
难度: 中等查看答案及解析
-
表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍,下列说法正确的是( )

A. 原子半径大小关系为:R>Y>X
B. X有多种同素异形体,而Y不存在同素异形体
C. 根据元素周期律可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性
D. 氢化物熔沸点:H2R>H2Y
难度: 中等查看答案及解析
-
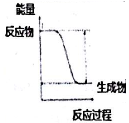
化学能与热能、电能等能相互转化.则化学能与其他能量相互转化说法正确的是( )

A. 中和反应中,反应物的总能量比生成物的总能量低
B. 化学反应中能量变化的主要原因是化学键的断裂与生成
C. 图I所示的装置能将化学能转变为电能
D. 图Ⅱ所示的反应为吸热反应
难度: 中等查看答案及解析
-
下列实验现象或图象信息不能充分说明相应化学反应是放热反应的是( )
A
B
C
D
反应装置图或图象
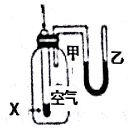

实验现象
温度计的水银柱不断上升
反应物总能量大于生成物总能量
反应开始后,甲处液面低于乙处液面
反应开始后,针筒活塞向右移动
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图是课外活动小组设计的用化学电源使LED灯发光的装置,下列说法错误的是 ( )
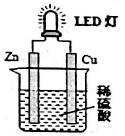
A. 如果将硫酸换成橙汁,导线中不会有电子流动
B. 氢离子在铜片表面被还原
C. 锌是负极,电子从锌片经导线流向铜片
D. 装置中存在化学能→电能→光能”的转换
难度: 中等查看答案及解析
-
已知可逆反应:N2(g)+3H2(g)
2NH3 (g).这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列关于此反应的说法中错误的是( )
A. 升高反应体系的温度,可使反应速率变大
B. 该反应中N2不可能100%转化为NH3
C. 该反应达到平衡状态时.N2、H2和NH3三者的浓度一定相等
D. 为了提高H2的转化率,可适当提高N2的浓度
难度: 中等查看答案及解析
-
如图是四种常见有机物的比例模型示意图。下列说法正确的是

A.甲能使酸性KMnO4溶液褪色
B.乙可与溴水发生取代反应而使溴水褪色
C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特键
D.丁在稀硫酸作用下可与乙酸发生取代反应
难度: 中等查看答案及解析
-
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是

A. A、B组成的化合物中可能含有共价键
B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素
D. 离O点越远的元素原子半径越大
难度: 中等查看答案及解析
-
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
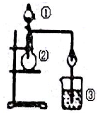
A
浓盐酸
MnO2
NaBr溶液
氧化性Cl2>Br2
B
浓氨水
碱石灰
Al2(SO4)3溶液
Al(OH)3具有两性
C
浓硫酸
Na2SO3
FeCl3溶液
SO2具有还原性
D
稀盐酸
Na2C03
Na2Si03
非金属性:C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等。已知:Ce4++Fe2+=Ce3++Fe3+。下列说法正确的是( )
A. Ce元素位于元素周期表第六周期第IIIB族
B.
、
是同素异形体
C. 铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
D. 铈的原子核外有58个电子
难度: 中等查看答案及解析
-
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )

A. 金属性:N>Q
B. 最高价氧化物对应水化物酸性:M>Y>N
C. 简单离子半径:Q>N>X
D. 原子序数:Z>M>Y>X
难度: 中等查看答案及解析