-
(1)现有如下A、B两反应:
A: 2NaOH+H2SO4=Na2SO4+2H2O;B:Zn+H2SO4=ZnSO4+H2↑
则A、B反应能设计成为原电池的是____(填“A”或“B”)。
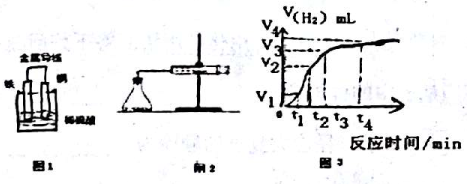
(2)某原电池示意图如图1,则该电池负极电极的反应方程式为_______________。
(3)若该电池反应过程中共有0.3mol电子发生转移,则生成的气体体积在标准状况下的体积是_____L。
(4)为了研究Fe与稀H2SO4反应的速率,某同学通过如图2实验装置测定反应中生成的H2体积,绘制了如图3所示的曲线,在该实验过程中发现锥形瓶温度升高。请回答以下问题。
在0~tl、tl~t2、t2~t3各个时间段里,反应速率最大的时间段是____,产生这种情况可能的原因是_____;该实验过程中收集到气体最多的是在______时间内。
(5)为了减缓该反应的速率,你认为可行的方法是________。
A.向H2SO4溶液中加蒸馏水 B.将Fe片改成Fe粉
C.向H2SO4溶液中加Na2SO4溶液 D.向H2SO4溶液中滴入几滴Cu(NO3)2溶液.
-
现有如下两个反应:
A.2NaOH+H2SO4 = Na2SO4+2H2O B.CH4+2O2 = CO2+2H2O
(1)根据反应的本质,两个反应都为________反应(放热或吸热),判断两个反应能否设计为原电池?(填“能或不能”)A________ B________
(2)如果能,最好应选择________作电解质溶液(NaOH或H2SO4)。则负极电极反应式:________,正极电极反应式:________(若均不能则此问不填)
-
(8分)现有如下两个反应:
A.2NaOH+H2SO4 = Na2SO4+2H2O B.CH4+2O2 = CO2+2H2O
(1)根据反应的本质,两个反应都为________反应(放热或吸热),判断两个反应能否设计为原电池?(填“能或不能”)A________ B________
(2)如果能,最好应选择________作电解质溶液(NaOH或H2SO4)。则负极电极反应式:________,正极电极反应式:________。(若均不能则此问不填)
-
(8分)现有如下两个反应:
A.2NaOH+H2SO4 = Na2SO4+2H2O B.CH4+2O2 = CO2+2H2O
(1)根据反应的本质,两个反应都为________反应(放热或吸热),判断两个反应能否设计为原电池?(填“能或不能”)A B________
(2)如果能,最好应选择________作电解质溶液(NaOH或H2SO4)。则负极电极反应式:________,正极电极反应式:________。(若均不能则此问不填)
-
现有如下两个反应:
A.2NaOH+H2SO4==Na2SO4+2H2O B.CH4+2O2==CO2+2H2O
(1)根据反应的本质,两个反应都为________反应(放热或吸热),判断两个反应能否设计为原电池?(能或不能)A________ B________
(2)如果不能,说明其理由________
(3)如果能,最好应选择________电解质溶液(NaOH或H2SO4)。则负极电极反应式:
________,正极电极反应式:________ 。
-
现有如下两个反应:A.2NaOH+H2SO4==Na2SO4+2H2O B.CH4+2O2==CO2+2H2O
(1)根据反应的本质,两个反应都为________反应(放热或吸热),判断两个反应能否设计为原电池?(能或不能)
A________ B________
(2)如果不能,说明其理由________
(3)如果能,最好应选择________电解质溶液(NaOH或H2SO4)。
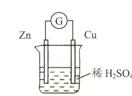
(4)上图是一个原电池装置,则负极电极反应式:________
正极电极反应式:________
-
现有如下两个反应:
A、2NaOH+H2SO4═Na2SO4+2H2O
B、CH4+2O2═CO2+2H2O
(1)根据反应的本质,两个反应都为________反应(放热或吸热),判断两个反应能否设计为原电池?(能或不能)
A________ B________
(2)如果不能,说明其理由________
(3)如果能,最好应选择________电解质溶液(NaOH或H2SO4).则负极电极反应式:________正极电极反应式:________.
-
下列属于氧化还原反应,且为吸热反应的是
A.CaO+H2O====Ca(OH)2 B.C+H2O CO+H2
CO+H2
C.Zn+2H+=====Zn2++H2↑ D.2NaOH+H2SO4===Na2SO4+2H2O
-
现有反应:
A.CaCO3 CaO+CO2↑
CaO+CO2↑
B.Zn+H2SO4=ZnSO4+H2↑
C.C+CO2 2CO
2CO
D.2KOH+H2SO4=K2SO4+2H2O
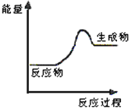
(1)上述四个反应中属于氧化还原反应且反应过程中能量变化符合如图的是_______(填反应序号)。
(2)在常温下,上述四个反应中可用于设计原电池的是__________(填反应序号),根据该原电池回答下列问题:
①负极材料是______,负极发生______(填“氧化”或“还原”)反应;正极反应式为_____。
②当导线中有1 mol电子通过时,理论上发生的变化是 _______ (填序号)。
a.溶液增重32.5 g b.溶液增重31.5 g
c.析出1g H2 d.析出11.2LH2
(3) 对于反应B,将足量且等量的形状相同的锌块分别加入到等浓度等体积的两份稀硫酸X、Y中,同时向X中加入少量饱和CuSO4溶液,发生反应生成氢气的体积(V)与时间(t)的关系如图所示。
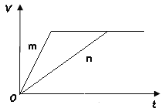
① m曲线表示锌与稀硫酸_________(填“X”或“Y”)反应。
② 锌分别与稀硫酸X、Y反应时,反应速率不同的原因是________(填序号)。
a. CuSO4作催化剂
b.加入硫酸铜溶液增大了c( )
)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应2H2 + O2=2H2O设制一个化学电池(材料均用碳棒),回答下列问题:
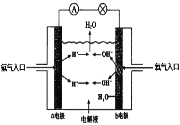
该电池的a极是______,(填正极或负极),若电解质溶液是稀硫酸,则 移向______极,(填a或b),写出b极上的电极反应式________________.
移向______极,(填a或b),写出b极上的电极反应式________________.
-
(16分,每空2分)现有如下两个反应:
(A)KOH + HNO3 = KNO3 + H2O (B)H2SO4+ Zn= ZnSO4+H2↑
(1)根据两反应本质判断能否设计成原电池:(A) (B) 。
(2)如果不能,说明其原因 。
(3)如果可以,则写出作原电池的正极材料名称: ,电极反应式:负极 ;正极 。
(4)在铜锌原电池中,以稀硫酸为电解质溶液,若工作一段时间后,锌片的质量减少了32.5克,则铜片表面析出了氢气 L,(标准状况下),导线中通过 mol电子。




