-
下列关于有机物说法正确的是( )
A.工业上可通过石油分馏直接得到甲烷、乙烯和苯
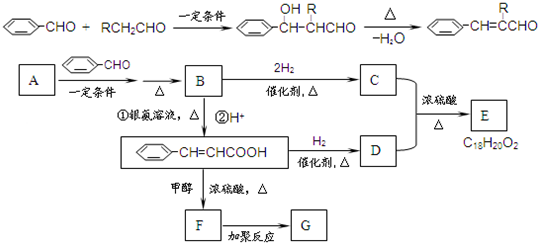
B.一定条件下,HCOOH、HCHO和葡萄糖都能发生银镜反应
C.实验室可用酸性高锰酸钾溶液鉴别苯、甲苯和己烯
D.棉、麻、丝、毛及合成纤维完全燃烧的产物中只有CO2和H2O难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.14C中含有14个中子
B.1H、2H、3H是同一种核素
C.根据酸溶液中c(H+)大小,可将酸分为强酸和弱酸
D.根据分散质颗粒大小,可将分散系分为浊液、胶体和溶液难度: 中等查看答案及解析
-
下列有关化学实验的说法中,不正确的是( )
A.用碱石灰可以干燥NH3、H2和C2H4三种气体
B.用萃取法分离溴水(过量)和KI溶液反应生成的碘单质
C.用煤油来保存少量金属钠
D.实验室在点燃乙烯前要检验乙烯的纯度难度: 中等查看答案及解析
-
用nA表示阿伏加德罗常数的值.下列说法正确的是( )
A.1mol乙基(-CH2CH3)中含有共价键的总数为7nA
B.粗铜精炼时转移1mol电子,阳极上溶解的Cu原子数一定为0.5nA
C.7.8g Na2O2中含有的阴离子总数为0.1nA
D.标况下11.2L CO和CO2混合气体中,所含碳原子数为nA难度: 中等查看答案及解析
-
下列表达中,正确的是( )
A.饱和氯水中可大量共存Na+、CO32-、SO32-
B.溶液中可大量共存Mg2+、HCO3-、SO42-、OH-
C.向稀硝酸中加入过量的铁粉:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
D.AlCl3溶液和过量浓氨水混合:Al3++4NH3•H2O=Al(OH)4-+4NH4+难度: 中等查看答案及解析
-
水的电离平衡曲线如图所示.下列说法正确的是( )

A.图中对应点的温度关系为:a>b
B.水的电离常数KW数值大小关系为:b>d
C.温度不变,加入少量NaOH可使溶液从c点变到a点
D.在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性难度: 中等查看答案及解析
-
a、b、c、d是短周期元素,在周期表中的相对位置如图所示.c元素原子核外M层电子数是K层电子数的2倍.下列说法中,错误的是( )
a b c d
A.原子半径:c<b
B.气态氢化物的稳定性:b>d
C.高温下,a单质可与c的氧化物发生置换反应
D.b的最高价氧化物对应的水化物中既含共价键又含离子键难度: 中等查看答案及解析
-
下列有关物质的量浓度关系中,正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.室温下,pH=3的醋酸与pH=11的NaOH溶液等体积混合:c (Na+)>c (CH3COO-)>c(OH-)>c(H+)
C.浓度均为0.1 mol•L-1CH3COONa、NaHCO3、-ONa溶液中:若c(OH-)分别为c1、c2、c3,则c3>c2>c1
D.NaHCO3溶液中:c(Na+)=c(H2CO3)+c(HCO3-)+2c(CO32-)难度: 中等查看答案及解析