-
具有下列性质的物质可能属于离子晶体的是
A. 熔点113 ℃,能溶于CS2 B. 熔点44℃,液态不导电
C. 熔点1124℃,易溶于水 D. 熔点180 ℃,固态能导电
难度: 简单查看答案及解析
-
下列关于有机物的说法不正确的是
A. 苯和乙烯均可以使溴水褪色,但褪色原理不同
B. 等物质的量的乙烯与乙醇完全燃烧消耗氧气的物质的量相等
C. 向制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明有乙酸剩余
D. 在C4H11N分子中,N原子以三个单键与其他原子相连接的同分异构体有8种(不考虑立体异构)
难度: 中等查看答案及解析
-
化学与生活息息相关,下列说法正确的是( )
A. 淀粉、纤维素、聚乙烯、油脂、蛋白质都是高分子化合物
B. 蔗糖和葡萄糖不是同分异构体,但属同系物
C. 油酸甘油酯在碱性条件下水解属于皂化反应
D. 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化
难度: 简单查看答案及解析
-
二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库等中的制冷剂。试判断二氟甲烷的结构简式 ( )
A. 有4种 B. 有3种 C. 有2种 D. 只有1种
难度: 中等查看答案及解析
-
现有三组混合液:①乙酸乙酯和乙酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.
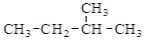 的名称为3-甲基丁烷
的名称为3-甲基丁烷B. CH3CH2CH2CH2CH3和
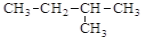 互为同素异形体
互为同素异形体C. CH3CH2OH和
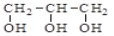 具有相同的官能团,互为同系物
具有相同的官能团,互为同系物D.
和
为同一物质
难度: 简单查看答案及解析
-
从植物中分离出的活性化合物zeylastral的结构简式如图所示,下列说法错误的是( )
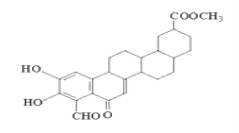
A. 1mol zeylastral最多与5molH2发生反应
B. 能与FeCl3溶液、银氨溶液发生反应
C. 化合物 zeylastral可以发生水解反应
D. 1mol zeylastral可与2molBr2发生反应
难度: 中等查看答案及解析
-
有5种有机物:
 ⑤CH2=CH—CH=CH2, 其中可用于合成
⑤CH2=CH—CH=CH2, 其中可用于合成 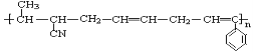 高分子材料的正确组合为
高分子材料的正确组合为A. ①②④ B. ①②⑤ C. ②④⑤ D. ③④⑤
难度: 中等查看答案及解析
-
1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。对于C60与棒碳,下列说法正确的是
A.C60与棒碳中所有的化学键都是非极性共价键
B.棒碳不能使溴水褪色
C.C60在一定条件下可能与CuO发生置换反应
D.棒碳与乙炔互为同系物
难度: 中等查看答案及解析
-
下列说法正确的是
A. 光照下,1 mol CH4最多能与4 mol Cl2发生取代反应,产物中物质的量最多的是CCl4
B. 苯与浓硝酸和浓硫酸的混合液在一定条件下能发生取代反应
C. 甲烷与乙烯混合物可通过溴的四氯化碳溶液分离
D. 乙烯和苯分子中均含独立的碳碳双键,都能与H2发生加成反应
难度: 简单查看答案及解析
-
一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
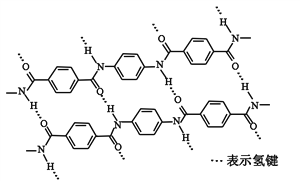
下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:

难度: 中等查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(
)是最简单的一种。下列关于该化合物的说法错误的是( )
A. 与环戊烯互为同分异构体 B. 二氯代物超过两种
C. 所有碳原子均处同一平面 D. 生成1 molC5H12至少需要2 molH2
难度: 中等查看答案及解析
-
在有机物中,若碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子.含有手性碳原子的分子一般是手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是( )
A. CBr2F2 B. CH3CH2OH C. CH3CH2CH3 D. CH3CH(OH)COOH
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 含有共价键的化合物一定是共价化合物
B. 只含有离子键的化合物才是离子化合物
C. 并非只有非金属原子间才能形成共价键
D. 由共价键形成的分子一定是共价化合物
难度: 简单查看答案及解析
-
下列分子或离子中,含有孤对电子的是( )
A. H2O B. CH4 C. SiH4 D. NH4+
难度: 中等查看答案及解析
-
下列过程中,共价键被破坏的是( )
A. 碘升华 B. 溴蒸气被木炭吸附
C. 酒精溶于水 D. HCl气体溶于水
难度: 简单查看答案及解析
-
与CO互为等电子体的是( )
A. CO2 B. N2 C. HCl D. O2
难度: 简单查看答案及解析
-
a、b、c、d为原子序数依次增大的四种短周期主族元素.a的最外层电子数是内层电子数的3倍,b的M层上有1个电子,a与c同主族.下列说法不正确的是( )
A. 原子半径:b>c>d
B. 简单阴离子还原性:d>c
C. 气态氢化物稳定性:a>c
D. a、b可形成既含离子键又含共价键的离子化合物
难度: 中等查看答案及解析
-
长式周期表共有18个纵列,从左到右排为1~18列,即碱金属为第1列,稀有气体元素为第18列.按这种规定,下列说法正确的是( )
A. 第四周期第8列元素是铁元素
B. 只有第2列的元素原子最外层电子排布为ns2
C. 第14列元素中未成对电子数是同周期元素中最多的
D. 第15列元素原子的价电子排布为ns2np5
难度: 中等查看答案及解析
-
几种短周期元素的原子半径和主要化合价见表:
元素代号
X
Y
Z
L
M
Q
原子半径/nm
0.160
0.143
0.102
0.099
0.077
0.074
主要化合价
+2
+3
+6、-2
+7、-1
+4、-4
-2
下列说法正确的是
A.在化学反应中,M原子既不容易失去电子,又不容易得到电子
B.等物质的量的X、Y的单质与足量盐酸反应,生成的氢气一样多
C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应
D.Z的氢化物的稳定性强于L的氢化物的稳定性
难度: 中等查看答案及解析
-
类推法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否.根据你所掌握的知识,判断下列类推结论中正确的是( )
化学事实
类推结论
A
卤素单质的沸点:F2<Cl2<Br2<I2
氢化物沸点:HF<HCl<HBr<HI
B
用电解熔融MgCl2可制得金属镁
用电解熔融NaCl也可以制取金属钠
C
将CO2通入Ba(NO3)2溶液中无沉淀生成
将SO2通入Ba(NO3)2溶液中也无沉淀生成
D
Al与S加热时直接化合生成Al2S3
Fe与S加热时也能直接化合生成 Fe2S3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
2014年12月科学家发现了迄今为止最轻的冰﹣﹣“冰十六”,它是水的一种结晶形式,有着像笼子一样、可以困住其他分子的结构.下列有关叙述中不正确的是( )
A. “冰十六”的密度比液态水小
B. “冰十六”与干冰由不同分子构成
C. “冰十六”可以包合气体分子
D. 液态水转变成“冰十六”是化学变化
难度: 简单查看答案及解析
-
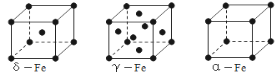
已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
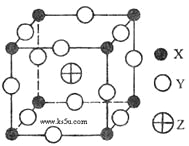
A. ZXY3 B. ZX2Y6 C. ZX4Y8 D. ZX8Y12
难度: 中等查看答案及解析
-
若ABn的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥理论,下列说法正确的是( )
A. 若n=2,则分子的空间构型为V形
B. 若n=3,则分子的空间构型为三角锥型
C. 若n=4,则分子的空间构型为正四面体型
D. 以上说法都不正确
难度: 简单查看答案及解析
-
下列叙述正确的是
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.H2O2的分子是含有极性键的非极性分子
D.在SiC和SiO2晶体中,都不存在单个小分子
难度: 中等查看答案及解析
-
下列有关金属晶体判断正确的是
A.简单立方、配位数6、空间利用率68%
B.钾型、配位数6、空间利用率68%
C.镁型、配位数8、空间利用率74%
D.铜型、配位数12、空间利用率74%
难度: 中等查看答案及解析
-
下列各项的叙述中都包含两个数值,前一数值大于后一数值的是( )
A. 单质碘中的分子间作用力和干冰中的分子间作用力
B. NaCl晶体中与一个Cl﹣紧邻的Na+数和CsCl晶体中与一个Cl﹣紧邻的Cs+数
C. 晶体硅中Si﹣Si键的键能和金刚石中C﹣C键的键能
D. 氨分子中N﹣H键的键角和甲烷分子中C﹣H键的键角
难度: 中等查看答案及解析
-
已知磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是( )
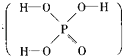
A.
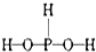 B.
B.  C.
C. 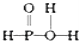 D.
D. 
难度: 中等查看答案及解析
-
已知X、Y、Z、W都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上气态化合物,W的族序数比X的族序数大1,则下列说法错误的是
A. Y和Z以质量比为7:16组成的共价化合物有两种
B. X和Y、X和Z组成的常见化合物,稳定性前者大于后者
C. X、Z、W简单离子的半径由大到小的顺序为:Z>W>X
D. X、Y、Z可以组成一种离子化合物,其中X、Y、Z元素原子个数比为4:2:3
难度: 困难查看答案及解析

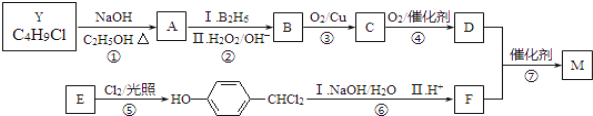
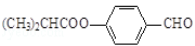 。合成M的一种途径如下:
。合成M的一种途径如下: