-
翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(1)基态Cr原子的电子排布式为_______;Fe位于元素周期表的____区。
(2)翡翠中主要成分硅酸锚钠表示为氧化物的化学式为________,其中四种元素第一电离能由小到大的顺序是________。
(3)钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?________。
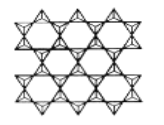
(4)在硅酸盐中存在 结构单元,其中Si原子的杂化轨道类型为________。当无限多个(用n表示)
结构单元,其中Si原子的杂化轨道类型为________。当无限多个(用n表示) 分别以3个顶角氧和其他3个
分别以3个顶角氧和其他3个 形成层状结构时(如图所示),其中Si、O原子的数目之比为________。若其中有一半的Si被Al替换,其化学式为________。
形成层状结构时(如图所示),其中Si、O原子的数目之比为________。若其中有一半的Si被Al替换,其化学式为________。
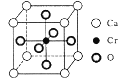
(5)Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为________,若Ca与O的核间距离为x nm,则该晶体的密度为_______g/cm3。
-
已知硅酸盐中,通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。Si2O44-四面体可用下图(a)表示。图(b)是一种无限长单链结构的多硅酸根,其化学式为

A.Si2O76- B.Si2O52- C.SiO32- D.Si4O116-
-
已知硅酸盐中,通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。Si2O44-四面体可用下图(a)表示。图(b)是一种无限长单链结构的多硅酸根,其化学式为
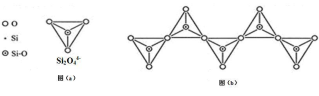
A.Si2O76- B.Si2O52- C.SiO32- D.Si4O116-
-
祖母绿被称为绿宝石之王,是四大名贵宝石之一,其主要成分为Be3Al2Si6O18,因含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)祖母绿宝石属于晶体,鉴别晶体最可靠的科学方法是_____________。
(2)基态Cr原子的价层电子排布式为_________;基态Si原子电子占据最高能级的电子云轮廓图为_________。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是_______,1 mol Cr(CO)6中含σ键的数目为_________;
(4)BeCl2分子的空间构型是_________,写出该分子的一种等电子体的分子式_________。它的二聚体Be2Cl4结构如图所示Cl-Be Be-Cl,,其中Be原子的杂化方式是_________。
Be-Cl,,其中Be原子的杂化方式是_________。
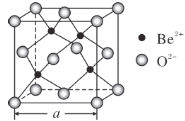
(5)BeO的立方晶胞如图所示,在该晶胞中与一个O2-距离最近且相等的O2-有________个。若该晶体的密度为d g·cm-3,设阿伏加德罗常数的值为NA,则晶胞边长a=________nm。(列出计算表达式)
(6)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用△表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]3+________ △[Fe(H2O)6]2+(填“>”、“=”或“<”),理由是___________。
-
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子。
(1)NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物的名称为:______________________。
(2)Al的电子排布式为______________________。
(3)配合物K[Cr(C2O4)2(H2O)]中的配体是:___________,H2O的中心原子的杂化轨道类型是:___________,与H2O互为等电子体的离子是:___________(任写一种)
(4)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
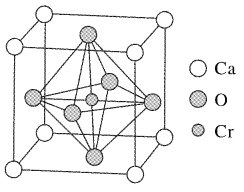
①该晶体的化学式为:_______________。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为________pm。
-
(12分)【物质结构与性质】翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1)Na、Al、Si、O四种元素电负性由大到小的顺序为 。
(2)Cr3+的基态核外电子排布式为 。
(3)Cr可形成配合物K[Cr(C2O4)2(H2O)2],与H2O互为等电子体的一种分子是 (填化学式),水分子中氧原子的杂化方式为 ,1 mol H2C2O4分子中含有的σ键的数目为 。
(4)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞如图所示。该复合氧化物的化学式可表示为 。
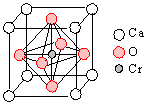
-
硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是
A.陶瓷 B.金刚石 C.水晶 D.大理石
-
硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是
A.陶瓷 B.金刚石 C.水晶 D.大理石
-
硅是带来人类文明的重要元素之一。下列物质中主要成分是硅酸盐的是( )
A.陶瓷 B.金刚石 C.水晶 D.大理石
-
下列有关硅及硅的化合物的叙述中,正确的是( )
A. 硅是光导纤维的主要成分 B. 硅是构成岩石与许多矿物的基本元素
C. SiO2是酸性氧化物,不与任何酸发生反应 D. 可以通过SiO2一步制得硅酸
结构单元,其中Si原子的杂化轨道类型为________。当无限多个(用n表示)
分别以3个顶角氧和其他3个
形成层状结构时(如图所示),其中Si、O原子的数目之比为________。若其中有一半的Si被Al替换,其化学式为________。






