-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,11.2 L SO3所含的氧原子数为1.5NA
B.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
C.常温常压下,4.0 g CH4中含有共价键的数目为NA
D.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
难度: 中等查看答案及解析
-
2014年11月APEC会议期间,北京市区天空湛蓝,PM2.5浓度为每立方米37微克,接近一级优水平。网友形容此时天空的蓝色为“APEC蓝”。下列有关说法不正确的是
A.开发新能源,如太阳能、风能等,减少对化石能源的依赖
B.直径接近于2.5×10-6m的颗粒物(PM2.5)分散在空气中形成的混合物具有丁达尔效应
C.燃煤进行脱硫脱硝处理,减少硫的氧化物和氮的氧化物的排放
D.通过吸收空气中CO2并利用廉价能源合成汽油可推广“绿色自由”计划
难度: 中等查看答案及解析
-
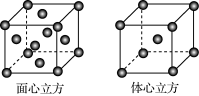
下列有关化学用语表达正确的是
A.碳酸氢根离子的水解方程式:HCO3-+H2O
H3O++CO32-
B.聚丙烯的结构简式:
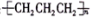
C.钾原子的结构示意图:
D.甲烷分子的比例模型:
难度: 中等查看答案及解析
-
常温下,在指定的溶液中一定能大量共存的离子组是
A.使pH试纸变蓝的溶液:Al3+、Na+、SO42 -、Cl-
B.c(SO32-)=0.1 mol·L-1的溶液:K+、MnO4- 、SO42 -、H+
C.c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2- 、CO32 -、Na+
D.加入苯酚显紫色的溶液:Na+、NH4+ 、Cl-、I-
难度: 困难查看答案及解析
-
下列有关物质的性质与应用的对应关系正确的是
A.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污
B.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
C.铝的熔点很高,可用于制作耐高温材料
D.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体
难度: 中等查看答案及解析
-
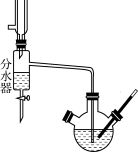
下列装置进行的相应实验,能达到实验目的的是
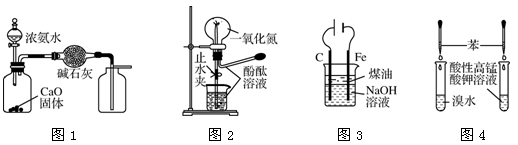
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可演示NO的喷泉实验
C.用图3装置制备Fe(OH)2并能较长时间观察其颜色
D.用图4装置验证苯中是否有独立的碳碳双键
难度: 中等查看答案及解析
-
下列化学反应的离子方程式中正确的是
A.金属钠投入水中:Na+H2O
Na++OH-+H2↑
B.漂白粉溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2
CaCO3↓+2HClO
C.用酸性的KMnO4溶液与H2O2反应:2MnO4- +10H++3H2O2
2Mn2++3O2↑+8H2O
D.用银氨溶液检验乙醛中的醛基:
CH3CHO+2[Ag(NH3)2]++2OH-
CH3COO-+NH4+ +3NH3+2Ag↓+H2O
难度: 中等查看答案及解析
-
下列各组物质之间通过一步就能实现如图所示转化的是
选项
物质转化关系
甲
乙
丙
丁
A
Al2O3
NaAlO2
Al
Al(OH)3
B
Na2O
Na2O2
Na
NaOH
C
CH2=CH2
CH3CH2OH
CH3CHO
CH3COOH
D
NO
NO2
N2
HNO3
难度: 中等查看答案及解析
-
短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素。下列说法不正确的是
A.W与X形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y
C.W的氢化物熔沸点比Z的氢化物熔沸点低
D.Y与R形成的化合物YR的熔点高、硬度大
难度: 困难查看答案及解析
-
下列叙述正确的是
A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B.稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
C.C(石墨,s)=C(金刚石,s) ΔH=+1.9 kJ·mol-1,则说明金刚石比石墨稳定
D.反应2CO(g)+2NO(g)
N2(g)+2CO2(g)在298 K时能自发进行,则它的,ΔS>0
难度: 中等查看答案及解析
-
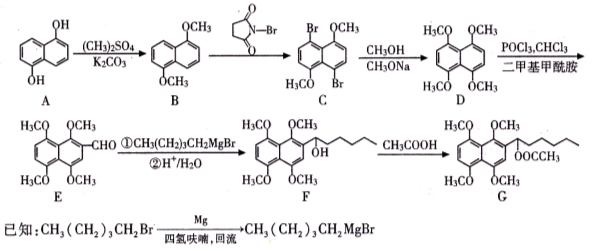
香柠檬油是从香柠檬树的果皮中提炼的橘子味的香油,33%的女用香水用到了这种原料。香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图。下列说法正确的是

A.香柠檬醚的分子式为C13H6O4
B.香柠檬酚通过取代反应可转化成香柠檬醚
C.1 mol香柠檬酚最多可与2 mol Br2发生反应
D.1 mol香柠檬酚在NaOH溶液中水解时能消耗3 mol NaOH
难度: 中等查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
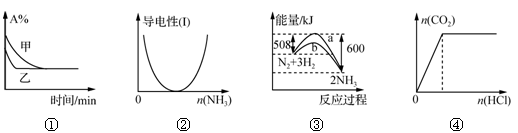
A.图①表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
B.图②表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C.图③表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
D.图④表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
难度: 困难查看答案及解析
-
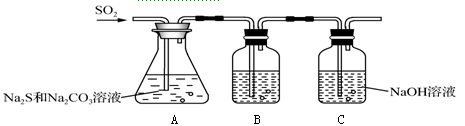
下列实验操作的现象与结论正确的是
A.鉴别大豆油与矿物油的方法是分别加入足量氢氧化钠溶液共热,分层的是矿物油
B.某钠盐溶液中加入盐酸酸化的硝酸钡溶液,有白色沉淀产生,则该钠盐一定是硫酸钠
C.在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,表明SO2具有漂白性
D.向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,有白色沉淀产生,蛋白质发生了变性
难度: 中等查看答案及解析
-
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.2 mol·L-1 NH3·H2O溶液与0.1 mol·L-1盐酸等体积混合:c(NH4+ )>c(Cl-)>c(OH-)>c(H+)
B.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COO-)<c(CH3COOH)
C.等物质的量浓度等体积的NH4HSO4溶液和NaOH溶液混合:c(Na+)=c(SO42 -)>c(NH4+ )>c(H+)>c(OH-)
D.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合所得溶液:c(CO32 -)+2c(OH-)=c(HCO3- )+c(H2CO3)+2c(H+)
难度: 困难查看答案及解析
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:
A(g)+xB(g)
2C(g) ΔH=a kJ·mol-1
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下表和下图:
容器
甲
乙
丙
容积
0.5 L
0.5 L
1.0 L
温度/℃
T1
T2
T2
反应物
起始量
1.5 mol A
0.5 mol B
1.5 mol A
0.5 mol B
6.0 mol A
2.0 mol B
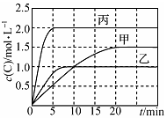
下列说法不正确的是
A.10 min内甲容器中反应的平均速率v(A)=0.10 mol·L-1·min-1
B.其他条件不变,甲容器中在20 min后,降低温度,平衡向正反应方向移动
C.保持其他条件不变,若起始时向乙容器中充入3.0 mol A、1.0 mol B和2.0 mol C,则反应达到新平衡前v(逆)>v(正)
D.T2 ℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,平衡时C的体积分数大于25%
难度: 极难查看答案及解析
-
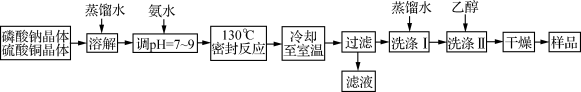
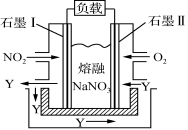
(12分)稀土元素是周期表中ⅢB族钪、钇和镧系元素之总称,金属活泼性仅次于碱金属和碱土金属元素,它们的性质极为相似,常见化合价为+3价。无论是航天、航空、军事等高科技领域,还是传统工农业,稀土的应用几乎是无所不在。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
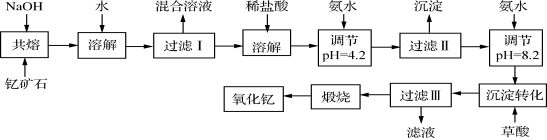
已知:
①有关金属离子形成氢氧化物沉淀时的pH见下表。
离子
开始沉淀时
的pH
完全沉淀时
的pH
Fe3+
2.7
3.7
Y3+
6.0
8.2
②Be(OH)2+2NaOH
Na2BeO2+2H2O
请回答下列问题:
(1)过滤Ⅲ所得滤液的溶质主要有______________。
(2)①欲从过滤I所得混合溶液中制得Be(OH)2沉淀,最好选用盐酸和________两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(3)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O
Fe(OH)3+3H+的平衡常数K= 。
(4)写出煅烧过程的化学方程式 。
难度: 极难查看答案及解析