-
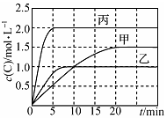
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)⇌2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0,5L | 0,5L | 1,0L |
| 温度/℃ | T1 | T2 | T2 |
反应物
起始量 | 1,5molA
0,5molB | 1,5molA
0,5molB | 6,0molA
2,0molB |
下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.025mol/
B.由图可知:T1<T2,且该反应为放热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
-
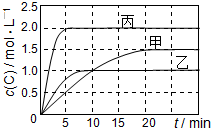
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)⇌2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0,5L | 0,5L | 1,0L |
| 温度/℃ | T1 | T2 | T2 |
反应物
起始量 | 1,5molA
0,5molB | 1,5molA
0,5molB | 6,0molA
2,0molB |
下列说法正确的是( )
A.10min内甲容器中反应的平均速率v(A)=0.025mol/
B.由图可知:T1<T2,且该反应为放热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
-
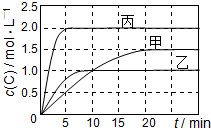
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |

下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g),各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
2C(g),各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
下列说法正确的是
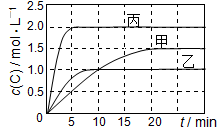
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol/(L•min)
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为75%
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g) + xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |

下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L·min)
B.由图可知:T1<T2,且该反应为放热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
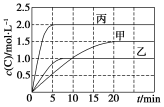
下列说法正确的是( )
A.10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1 ℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
-
向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
| 容器 | 甲 | 乙 | 丙 |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 3.0molA 1.0molB |
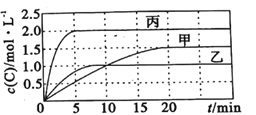
则: (1)该反应为____________(填 “放热反应”或“吸热反应”)
(2)丙容器中前5分钟的A的反应速率为__________
(3)该可逆反应达到平衡后,为在提高反应速率的同时提高B的转化率,可采取的措施有___________(填标号)。
a.按体积比1:1再充入A和B b.改用高效催化剂 c.升高温度 d.增加A的浓度 e. 增加C的浓度
(4)乙容器中的化学平衡常数为_____________
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g) + xB(g)  2C(g)。各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量、反应过程中C的浓度随时间变化关系分别以下表和下图表示:

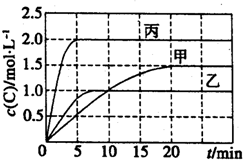
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:

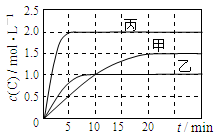
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1 ·min-1
B.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
C.由图可知:T1<T2,且该反应为放热反应
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
-
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。
2C(g)。
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
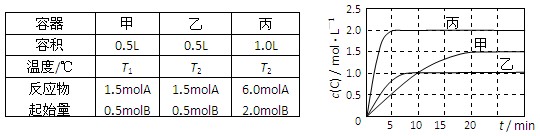
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L·min)
B.由图可知:T1<T2,且该反应为吸热反应
C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25%
2C(g) ΔH=a kJ·mol-1