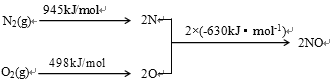
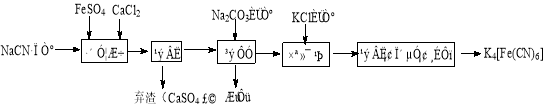
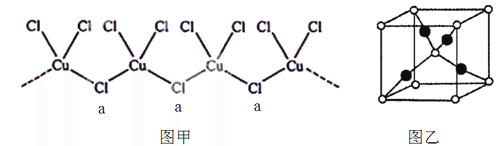
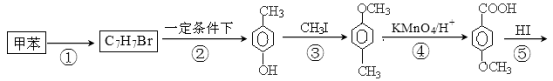
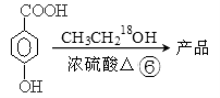
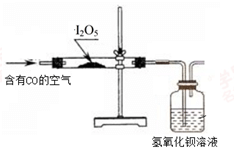
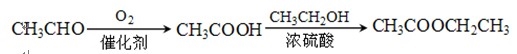-
O、Si、Al是地壳中含量最多的三种元素,Na、Mg、Cl是海水中的重要元素。下列说法正确的是
A.普通玻璃、水泥成分中都含有O、Si、Al三种元素
B.从海水中制备Na、Mg、Al三种元素单质的反应都是氧化还原反应
C.电解熔融状态的SiO2、Al2O3可以制得Si、Al,且都有氧气生成
D.加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl2
难度: 简单查看答案及解析
-
下列说法正确的是:①植物油和裂化汽油都可以使溴水褪色;②糖类、油脂和蛋白质都能发生水解反应;③蛋白质溶液中加入浓的硫酸铵溶液会有沉淀析出;④防腐剂福尔马林可用作食品保鲜剂;⑤乙醇、乙酸、乙酸乙酯都能发生取代反应;⑥汽油、甘油和花生油都是混合物,无固定的沸点,只有花生油能与氢氧化钠溶液反应
A.①③⑤ B.①②⑤ C.②④⑥ D.②③⑥
难度: 简单查看答案及解析
-
如图所示,X、Y、Z为短周期元素,且X、Z的核外电子数之和等于Y的核外电子数,下列说法不正确的是
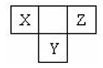
A.三种元素中,Z元素原子半径最小
B.X、Y 两种元素的气态氢化物能相互反应
C.Z位于元素周期表中第2周期、第ⅥA族
D.Y元素的气态氢化物与X 的最高价氧化物对应的水化物能发生氧化还原反应
难度: 中等查看答案及解析
-
在反应“X + 酸
化合物 + H2O”中,X不可能是
A.FeO B.NaF C.SiO2 D.C2H5OH
难度: 简单查看答案及解析
-
下列各选项所描述的两个量中,前者大于后者的是
A.NH4Cl溶液中NH4+和Cl-数目
B.纯水在100℃和25℃时的pH
C.完全中和相同pH且相同体积的氨水和NaOH溶液,所需的0.1mol·L-1盐酸体积
D.CH3COONa溶液加水稀释前后的
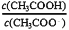
难度: 中等查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
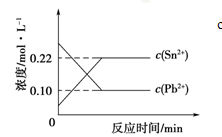
下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后, c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
难度: 中等查看答案及解析
-
最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如右图所示。下列说法不正确的是
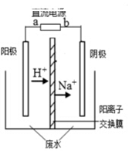
A.若以CH4—空气燃料电池为直流电源,燃料电池的a极应通入空气
B.阳极反应CH3CHO -2e- + H2O = CH3COOH +2H+
C.电解过程中,阴极区Na2SO4的物质的量增大
D.电解过程中,两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2
难度: 困难查看答案及解析