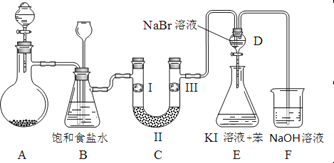
-
美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与12C是同位素
难度: 简单查看答案及解析
-
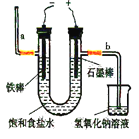
在下列状态下,能导电的电解质是
A. 氨水 B. 液态氯化氢 C. 二氧化碳气体 D. 熔融的氧化铝
难度: 中等查看答案及解析
-
俄罗斯科学家最近合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义.该原子的中子数与质子数之差是( )
A. 175 B. 114 C. 61 D. 289
难度: 简单查看答案及解析
-
人类对原子结构的认识是逐渐深入的,下列原子结构模型中最切近实际的是
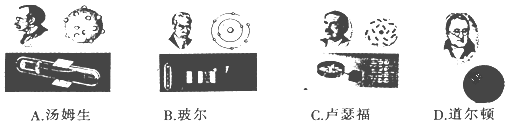
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
分类法在化学的发展中起到非常重要的作用,下列分类标准合理的是
①根据氧化物的组成元素将氧化物分成酸性氧化物碱性氧化物和两性氧化物
②根据反应中是否有化合价变化将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔效应将分散系分为溶液胶体和浊液
④根据反应中的热效应将化学反应分为放热和吸热反应
⑤根据水溶液能否导电将化合物分为电解质和非电解质
A. ②④ B. ②③④ C. ①③⑤ D. ⑤④①②
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 溶液和胶体的本质区别是当一束强光通过胶体时,可出现一条光的通路,溶液则没有此现象
B. 氯化铝溶于水后产生的氢氧化铝胶体吸附了水中悬浮颗粒并沉降,达到净水目的。
C. 凡是均一、透明的、没有丁达尔现象的液体都是溶液
D. 过滤氢氧化铝胶体溶液,可得到氢氧化铝固体。
难度: 简单查看答案及解析
-
为了除去硝酸钾晶体中所含的硫酸钙和硫酸镁,先将它配成溶液,然后加入KOH、K2CO3、Ba(NO3)2等试剂,配以过滤、蒸发结晶等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序正确的是
A. K2CO3→Ba(NO3)2→KOH→HNO3 B. Ba(NO3)2→KOH→HNO3→K2CO3
C. KOH→K2CO3→Ba(NO3)2→HNO3 D. Ba(NO3)2→KOH→K2CO3→HNO3
难度: 中等查看答案及解析
-
N2O是一种有甜味、能溶于水、能助燃的无色气体,它能刺激神经使人发笑,俗称“笑气”;它具有麻醉作用,曾用作牙科麻醉剂。现有等物质的量的笑气和二氧化碳,下列数值不一定相同的是
A. 体积 B. 电子数 C. 原子数 D. 分子数
难度: 简单查看答案及解析
-
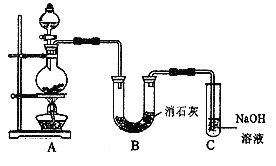
氯气(Cl2)和氧气(O2)都是活泼的非金属单质,在一定条件下它们都能跟甲烷(CH4)反应。已知O2和CH4充分反应后的生成物是CO2和H2O,由此推断Cl2和CH4充分反应后的最终生成物是
A. CCl4和HCl B. CCl4和H2 C. CH2C12和H2 D. C和HCl
难度: 中等查看答案及解析
-
在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是
A. 加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl-
B. 新制氯水使红玫瑰变为白玫瑰,说明有Cl2
C. 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO
D. 光照新制氯水有气泡逸出,该气体一定是Cl2
难度: 中等查看答案及解析
-
现有H2SO4、Ba(OH)2、Na2CO3和氯水四种溶液,有如图所示的相互关系,图中每条线段两端的物质可以发生化学反应。下列推断合理的是
A. M一定是Ba(OH)2 B. Y可能是氯水
C. X一定是Na2CO3溶液 D. Z可能是H2SO4
难度: 中等查看答案及解析
-
许多元素有多种核素,如氧元素存在168O、178O、188O三种核素,氢元素有11H、21H、31H三种核素。下列说法正确的是
A. 由168O、11H、21H三种核素最多可能组成4种水分子
B. 10.0g由21H、168O组成的水分子其中含质子数为5NA
C. 10.0g由31H、168O组成的水分子其中含中子数为5NA
D. 由 31H和168O两种核素组成的水分子,其摩尔质量为18
难度: 中等查看答案及解析
-
下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A. 150 mL 3 mol·L-1的KClO3 B. 75 mL 2 mol·L-1的NH4Cl
C. 350 mL 3 mol·L-1的NaCl D. 150 mL 0.5mol·L-1的CaCl2
难度: 中等查看答案及解析
-
将足量的二氧化锰与40 mL10 mol·L-1浓盐酸反应产生的氯气同0.1 mol二氧化锰与足量的浓盐酸反应产生的氯气相比
A. 两者产生的氯气一样多 B. 前者产生的氯气的量是后者的2倍
C. 后者产生的氯气的量比前者多 D. 后者产生的氯气的量是前者的2倍
难度: 中等查看答案及解析