-
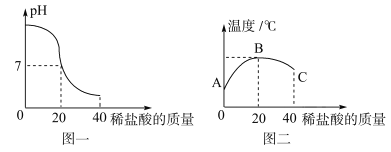
紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品( )
A. 食盐 B. 味精 C. 食醋 D. 香油
难度: 简单查看答案及解析
-
中国诗词既蕴含人文思想,又焕发理性光辉.对下列划线部分的化学解释不合理的是( )
A. 花气袭人知骤暖,喜鹊穿树喜新晴﹣温度高分子运动加快
B. 何意百炼钢,化为绕指柔﹣生铁经不断煅烧捶打氧化,降低碳的含量,变成钢
C. 千锤万凿出深山,烈火焚烧若等闲﹣煅烧石灰石,不发生化学变化
D. 美人首饰侯王印,尽是沙中浪底来﹣金的性质稳定,在自然界中以单质形态存在
难度: 中等查看答案及解析
-
我省明代科学家宋应星所著的
天工开物
中,详细记述了金、铜、铁、锌等金属的开采和冶炼方法,记述的金属中金属活动性最强的是
A. 金 B. 铜 C. 铁 D. 锌
难度: 简单查看答案及解析
-
化学肥料“三要素”是( )
A. C、H、O B. N、 C. K C.N、S、P D. N、P、K
难度: 简单查看答案及解析
-
化学元素含量的多少对人体健康有着重要的影响。人体缺钙易引发的疾病是
A.贫血 B.夜盲症 C.骨质疏松 D.甲状腺肿大
难度: 中等查看答案及解析
-
下列对化学基本观念的认识不正确的是
A. 微粒观:一氧化碳分子由一个碳原子和一个氧原子构成
B. 能量观:天然气燃烧放出大量的热
C. 分类观:纯碱和烧碱从组成上都属于碱
D. 守恒观:电解水反应前后,元素种类和原子数目均不变
难度: 中等查看答案及解析
-
N(NO2)3是科学家近年发现的一种新型火箭燃料.下列关于N(NO2)3说法正确的是
A. N(NO2)3的相对分子质量为152
B. N(NO2)3中氮元素与氧元素的质量比是2:3
C. N(NO2)3中总共有3个N原子和6个O原子
D. N(NO2)3中氮元素的质量分数为
×100%
难度: 中等查看答案及解析
-
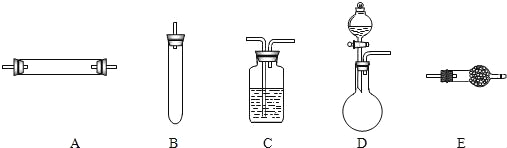
下列图示中的“错误实验操作”与图下面对应的“可能产生的后果”不一致的是( )
A.
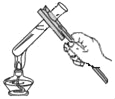
液体喷出
B.
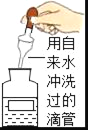
污染试剂
C.
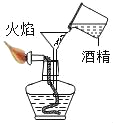
酒精溅出
D.
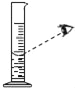
读数偏大
难度: 简单查看答案及解析
-
英国化学家亨利·卡文迪许是燃素说的信仰者。1766年,他用铁、锌、锡等六种金属与稀硫酸、稀盐酸作用制得“可燃空气”,并将其表示为:
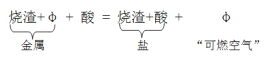
用所学化学知识判断, 下列说法正确的是
A.“可燃空气”是从金属中分解出来的 B.上述六种金属包括铜
C.“可燃空气”可以用排水集气法收集 D.上述反应属于复分解反应
难度: 中等查看答案及解析
-
在化学反应前后,物质所含元素化合价发生变化的反应属于氧化还原反应。氧化还原反应与四种基本化学反应类型间的关系如图所示,下列举例中错误的是:

A.例l: C+O2
CO2 B.例2:2H2O
2H2↑+O2↑
C.例3: Mg(OH)2+2HCl=MgCl2+2H2O D.例4: Cu+2AgNO3=2Ag+Cu(NO3)2
难度: 中等查看答案及解析
-
现有一包由3.2g铜、13g锌和2g 碳组成的粉末,放到一定量的AgNO3溶液中,完全反应后得到的固体为m种,溶液中溶质为n种.下列说法中不正确的是( )
A. 若m=2,则n=2或3 B. 若固体中金属的质量为 48g,则m=4
C. 当m=3时,溶液可能呈蓝色 D. 反应后固体的质量不可能超过56g
难度: 困难查看答案及解析
-
如图是四种粒子的结构示意图,下列说法正确的是( )
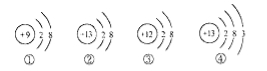
A.②③属于同种元素 B.②④的化学性质相同
C.②的符号为Al+3 D.①③形成的化合物是MgF2
难度: 中等查看答案及解析
-
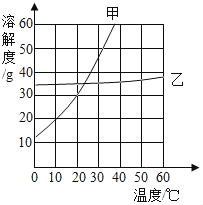
某次蔗糖溶解实验过程如图所示,不考虑水分蒸发,下列判断错误的是

A. ②中溶液是饱和洛液
B. ③中溶液一定是不饱和溶液
C. ②③中溶液的溶质质量分数不相同
D. ③中溶液的溶质质量大于②中溶液的溶质质量
难度: 中等查看答案及解析
-
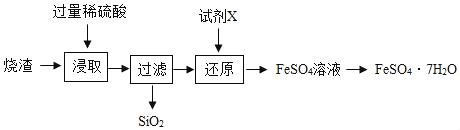
图中字母代表含硫元素的物质,下列判断错误的是
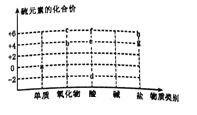
A.物质a在纯氧中燃烧可以生成物质b
B.物质c是二氧化硫
C.物质d中硫元素的化合价为-2价
D.物质d、e和f中一定那含有氢元素
难度: 中等查看答案及解析
-
除去下列物质中混有的少甘杂质(括号内为杂质),拟定的实验方案不可行的是
A.FeCl2溶液(CuCl2) ——加入过量的铁粉,过滤
B.KCl固体(KClO3)——加入少量的二氧化锰,并加热
C.CO气体(CO2)——通过足量的氢氧化钠溶液,并干燥
D.NaCl溶液(MgCl2) ——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性
难度: 中等查看答案及解析
-
2017年5月,中国科学家取得了将二氧化碳在一定条件下转化为化工原料的重大突破。二氧化碳和氢气反应制取乙烯,其反应的微观过程如下图所示。下列说法正确的是
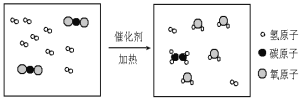
A.生成物分子数之比是1:2:4
B.乙烯的化学式为C2H4
C.反应前后分子种类、数目均不变
D.无机物不能转化为有机物
难度: 中等查看答案及解析
-
建立模型是学习化学的重要方法。下列有关模型正确的是( )
A.
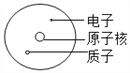 原子结构模型 B.
原子结构模型 B. 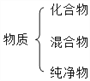 物质分类模型
物质分类模型C.
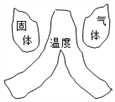 燃烧条件模型 D.
燃烧条件模型 D.  空气组成模型
空气组成模型难度: 中等查看答案及解析
-
根据反应事宜能推导影响化学反应的因素,以下推理中错误的是
选项
化学反应事实
影响化学反应的因素
A
铁能与硫酸铜溶液反应,银不能与硫酸铜溶液反应
反应物的性质
B
通常木炭充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳
反应温度
C
硫在氧气中比在空气中燃烧更剧烈
反应物的浓度
D
分别将等浓度的稀盐酸加入到锌片和锌粉中,锌粉反应更剧烈
反应物的接触面积
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是
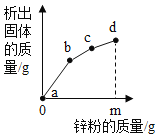
A. c点对应溶液中含有的金属离子为Zn2+和Cu2+
B. bc段(不含两端点)析出的金属是Fe
C. ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+和Fe2+
D. 若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1>m2
难度: 中等查看答案及解析