-
下列说法不正确的是
A. 一定温度下的焓变在数值上等于变化过程中的等容热效应
B. 焓变的符号是ΔH
C. 焓变的单位通常是kJ/mol
D. 常温下硝酸铵能够溶于水,因为其溶于水是一个熵增大的过程
难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量可向盐酸中加入适量的
A. NaOH(固体) B. Fe( NO3)3溶液
C. NH4Cl(固体) D. CH3COONa(固体)
难度: 中等查看答案及解析
-
一定温度下,体积相同、pH相同的H2SO4和CH3COOH溶液,与NaOH溶液中和时,两者消耗的NaOH的物质的量
A. 一样多 B. H2SO4消耗NaOH多
C. CH3COOH消耗NaOH多 D. 无法比较
难度: 中等查看答案及解析
-
25℃时,水的电离可达到平衡:H2O
H++OH- ΔH>0。下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量CH3COONa固体,平衡逆向移动,c (H+)降低
D. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
难度: 中等查看答案及解析
-
某温度下,重水( D2O)的离子积常数为1.6×10-15,若用定义pH一样规定pD= -lgc(D+),则在该温度下,下列叙述正确的是
A. 纯净的重水中,c(D+) ·c(OD-)>1.0×10-14
B. l L溶解有0.01 mol DCl的重水溶液,其pD=2
C. 1 L溶解有0. 01 mol NaOD的重水溶液,其pD=12
D. 纯净的重水中,pD=7
难度: 中等查看答案及解析
-
向新制氯水中加入少量下列物质,能增强溶液漂白能力的是
A. 碳酸钙粉末 B. 稀硫酸 C. 氯化钙溶液 D. 二氧化硫水溶液
难度: 中等查看答案及解析
-
已知
(b)、
(d)、
(p)的分子式均为C6H6,下列说法正确的是
A. b、d、p互为同分异构体,都属于芳香烃
B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应
D. b、d、p中只有b的所有原子处于同一平面
难度: 中等查看答案及解析
-
下列气体的制备和性质实验中,由现象得出的结论错误的是( )
选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
pH试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下图所示:

下列说法不正确的是
A. 反应①的产物中含有水 B. 反应②中只有碳碳键形成
C. 汽油主要是C5〜C11的烃类混合物 D. 图中a的名称是2-甲基丁烷
难度: 简单查看答案及解析
-
对于反应2X(g) +Y(g)
2Z(g),下列说法中正确的是
A. 由于K=
,随着反应的进行,Z的浓度不断增大,X、Y浓度不断减小,平衡常数不断增大
B. 当温度不变时,增大反应物的浓度,使K变小
C. 可逆反应达到平衡时,逆反应便立即停止了
D. 温度发生变化,上述反应的K值也发生变化
难度: 中等查看答案及解析
-
通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJ•mol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJ•mol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJ•mol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJ•mol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==
CH3OCH3(g)+
H2O(1)的ΔH =
kJ•mol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJ•mol-1
难度: 简单查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-6。己知:Ni(CO)4的熔点为42.2℃,固体杂质不参与反应。第一阶段: 将粗镍CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是( )
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第—阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,V生成[Ni(CO)4]=4V生成[(CO]
难度: 困难查看答案及解析
-
硫酸生产中炉气转化反应为2SO2(g)+O2(g)
2SO3(g)。研究发现,SO3的体积分数 (SO3%)随温度(T)的变化如曲线I所示。下列判断不正确的是
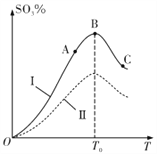
A. 该反应的正反应为放热反应
B. 曲线I上A、C两点反应速率的关系是:VA<VC
C. 反应达到B点时,2V正(O2) = V逆(SO3)
D. 已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则Ⅱ可表示用Fe2O3作催化剂的曲线
难度: 中等查看答案及解析
-
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PC15,反应PCl5(g)
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
下列说法不正确的是
A. 反应在前 50 s 的平均速率v(PCl3)=0.0016 mol • L-1 • s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol • L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入1.0 mol PC15、0.20 mol PC13和0.20 molCl2,反应达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0mol PC13和2.0mol Cl2,达到平衡时,PCl3的转化率小于80%
难度: 中等查看答案及解析
-
某温度下,在恒容密闭容器中充入N〇2,发生反应2NO2(g)
N2O4(g) ΔH<0,达到平衡后,下列说法不正确的是
A. 再充入少量NO2,达平衡后NO2的转化率增大
B. 再充入少量NO2,达平衡后NO2的体积分数增大
C. 再充入少量N2O4,平衡向逆反应方向移动,达到新平衡后NO2的体积分数减小
D. 升高温度,体系的颜色加深
难度: 中等查看答案及解析
-
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g) + Y(g)
M(g) +N(g),所得实验数据如下表所示:
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0〜5 min内,用N表示的平均反应速率v(N) =1.0×10-2 mol/(L • min)
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,反应达到平衡时,X的转化率为40%
D. 实验④中,反应达到平衡时,b<0.060
难度: 困难查看答案及解析