-
Fe3+具有较强的氧化性,能氧化SO2 。为验证该反应,用1 mol· L-1 FeCl3溶液与SO2进行实验。
(1)Fe3+氧化SO2的反应表示为 M。向黄色FeCl3溶液中通入SO2后,预期的实验现象是__________
(2)用如下图所示装置进行实验。

①将A装置加热,反应的化学方程式是____________
②A中产生的气体通入B中后,溶液变为红色。为证明B中Fe3+氧化了SO2,进行如下两个实验方案的实验:
I 取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,Fe3+与SO2发生氧化还原反应的离子方程式是____________。
II取B中红色溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀,证明B中Fe3+氧化了SO2。比较I和II实验方案,哪个方案更好,理由是___________。
(3)已知:B中溶液变红的反应:Fe3++6SO2  Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
(4)向1 mol· L-1 FeCl3溶液通入足量SO2,溶液很快变为红色;停止通入SO2,静置;15分钟后溶液逐渐变为黄色;60分钟后变为浅绿色。说明B中既发生反应M,也发生了反应N。结合反应速率和平衡移动原理解释溶液很快变红,最终变浅绿的原因____________。
-
用软锰矿[主要成分MnO2,还含SiO2 、Fe2O3、Al2O3、Cu2(OH)2CO3的等杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3)生产过程如下
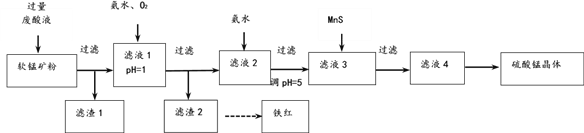
| Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 |
| 开始沉淀时 | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
| 完全沉淀时 | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
(1)含杂质的软锰矿使用前需将其粉碎,目的是______。
(2)滤渣1中含有的主要物质是_______。
(3)滤液1中,加氨水调控溶液pH至3.2,通入O2,反应的离子方程式是_______。若用H2O2代替O2,是否合理?理由是___________。
(4)软锰矿粉与硫酸和硫酸亚铁溶液反应的离子方程式是_________。
(5)滤液3中加入难溶电解质MnS的目的是(用离子方程式表示)_________。
(6)用重结晶法从滤液4中获取硫酸锰晶体的操作是:__________。
-
As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1mol AsO33-转化为AsO43-至少需要O2 ______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s) Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43- Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
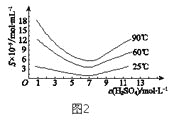
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3 在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。
(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
-
现有A、B、C、D、E五种元素,他们性质如下:
| A | 周期表中原子半径最小的元素 |
| B | 电负性最大的元素 |
| C | C的2p轨道中有三个未成对的单电子 |
| D | 原子核外电子数是B与C核外电子数之和 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答如下问题:
(1)基态E原子有_____个未成对电子,二价E离子的核外电子排布式为_______。
(2)A2D分子中D原子的杂化类型是______,D的氧化物DO3分子空间构型为_______。
(3)CA3极易溶于水,其原因主要是_____,试判断CA3溶于水后,形成CA3· H2O的合理结构:____ (填字母代号), 推理依据是_____。
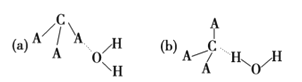
(4)在ESO4溶液中滴入过量氨水,形成配合物的颜色为______,反应的离子方程式为_____。
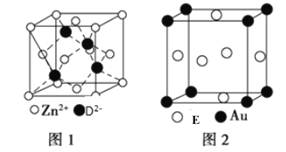
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为______。
(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为______(用含a、NA的代数式表示)g· cm-3。
-
高分子化合物PTT是一种性能优异的新型纤维。PTT的一种合成路线如下图:

已知: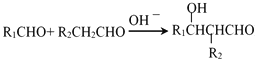 (
(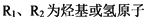 )
)
(1)已知A分子中有两种不同化学环境的氢原子,数目比为1:3,则A的结构简式为______。
(2)由B生成C的反应类型为______,C物质的化学名称为______。
(3)芳香烃D的相对分子质量为106,D的一氯代物只有2种,则D的结构简式为______。
(4)由E生成F的反应类型为______。
(5)G分子所含官能团名称为______。
(6)写出合成PTT的化学方程式______。
(7)有机物H的同分异构体有很多种,写出符合下列条件的一种同分异构体结构简式______。
①含有苯环 ②核磁共振氢谱有三个峰




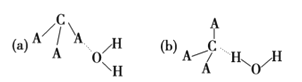


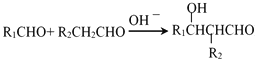 (
( )
)