-
下列各题中有关物质的比较,请用“>”、“<”、“=”填空:
(1)酸性:H3PO4______H2SO4,碱性:KOH______Mg(OH)2;
(2)氧化性:Cl2______S,还原性:Clˉ______Brˉ;
(3)稳定性:CH4______HF;
(4)微粒半径:Si______Na;Fˉ______Na+
(5)电子数目:H2O______CH4.难度: 中等查看答案及解析
-
下列反应中,属于放热反应的是______,属于吸热反应的是______.
A.锌粒与稀H2SO4反应制取H2 B.Ba(OH)2•8H2O与NH4Cl反应
C.氢气在氧气中燃烧生成水 D.高温煅烧石灰石使其分解
E.氢气还原氧化铜 F.葡萄糖在人体内氧化分解.难度: 中等查看答案及解析
-
(1)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应式为______,负极的电极反应式为______,原电池的总反应是______;当有6.5g锌溶解时,则在标准状况下,放出的氢气的体积为______,转移的电子数为______摩尔,溶液的酸性______(填“增强”或“减弱”).
(2)选用下列试剂和仪器设计一个原电池.画出装置图.标明原电池的正极、负极、电解质溶液,并写出正极、负极的电极反应.
试剂:铜片、铁片、银片、镁条、硫酸铜溶液、硝酸银溶液.
仪器:烧杯、导线、铁夹(若还需其它仪器可自己补充)难度: 中等查看答案及解析
-
现有下列短周期元素性质的数据:
回答下列问题:元素编号
元素性质① ② ③ ④ ⑤ ⑥ ⑦ ⑧ 原子半径
(10-10m)0.74 1.02 1.52 1.10 0.99 1.86 0.75 1.43 最高或最
低化合价+6 +1 +5 +7 +1 +5 +3 -2 -2 -3 -1 -3
(1)元素③在周期表中位置是______; 元素④与元素⑦相比较,气态氢化物较稳定的是______(填化学式);
(2)元素①是______(写元素符号),元素⑥是______(写元素符号),二者按照原子个数比为1:1形成的化合物与水反应的化学方程式为______;
(3)元素⑤与元素②的非金属性强弱顺序为______(写元素符号),元素⑤的单质加入到元素②的氢化物的水溶液中,反应的化学方程式为______;
(4)用电子式表示元素①氢化物的形成过程______;写出元素⑦氢化物的电子式______;写出实验室制元素⑤单质的化学反应方程式______ MnCl2+Cl2↑+2H2O难度: 中等查看答案及解析
-
某课外兴趣小组对H2O2的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)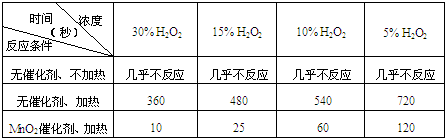
①该研究小组在设计方案时.考虑了浓度、______、______等因素对过氧化氢分解速率的影响.
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响______.
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试.测定结果如下:
①写出H2O2发生的化学反应方程式______ 2H2O+O2↑催化剂(MnO2) 操作情况 观察结果 反应完成所需的时间 粉末状 混合不振荡 剧烈反应,带火星的木条复燃 3.5分钟 块状 反应较慢,火星红亮但木条未复燃 30分钟 难度: 中等查看答案及解析
-
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为______;
(2)从开始至2min,Z的平均反应速率为______;Y的平均反应速率为______.
难度: 中等查看答案及解析
-
A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02g H2,用去0.4g A.B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体.
(1)写出两种元素的名称:A______,B______.
(2)用电子式表示A、B形成的化合物中化学键的形成过程______.难度: 中等查看答案及解析