-
下列说法正确的是( )
A. 海水淡化的常用方法有蒸馏法、离子交换法和电解法
B. 钢铁在焊接前可以用NH4C1溶液的酸性清除表面的铁锈
C. 甲醛和苯酚通过加聚反应制得酚醛树脂
D. 在轮船外壳上焊接锌块或接直流电源正极,均可减缓船体的腐蚀速率
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A. 实验室制氢气,为了加快反应速率,可向稀硫酸中滴加少量硝酸铜溶液
B. 可用勒夏特列原理解释2NO2(g)
N2O4(g)体系加压后颜色变深
C. N2(g)+ 3H2(g)
2NH3(g) ΔH<0可通过加压方式增大其平衡常数
D. 二氧化硫和乙烯两种气体分别通入Br2的CCl4溶液,能使溶液褪色的是乙烯气体
难度: 困难查看答案及解析
-
25℃时,下列有关电解质溶液说法正确的是( )
A. 1.0mol/L NH4HCO3溶液pH=8.0。由此可知Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. 向氨水中加入NH4C1固体,溶液中
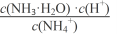 增大
增大C. 向CH3COONa溶液中滴加硫酸至中性时,c(SO42ˉ)<c(CH3COOH)
D. 下图中曲线可以表示向100mL 0.01 mol/LCH3COOH溶液中逐滴加入0.02mol/L NaOH溶液的pH变化情况(溶液体积变化忽略不计)。
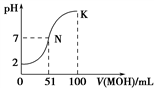
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A. BaSO3与稀HNO3反应:3BaSO3+2H++ 2NO3ˉ = 3BaSO4+ 2NO↑+H2O
B. 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32ˉ+Cl2+H2O = HCO3ˉ+Clˉ+HClO
C. Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42ˉ+Ba2++3OHˉ = Fe(OH)3 ↓ + BaSO4↓
D. 向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2 = 2Fe3++2Cl-
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A
用玻璃棒蘸取次氯酸钠溶液,点在pH试纸上
试纸最终显蓝色
次氯酸钠溶液显碱性
B
将铜粉加入1.0 mol/L Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D
将0.1 mol/L MgSO4溶液滴入NaOH溶液中至不再有沉淀产生,再滴加0.1 mol/L CuSO4溶液
白色沉淀变为蓝色沉淀
Cu(OH)2的溶解度比Mg(OH)2的小
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。已知亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3。则下列叙述中正确的是( )
A. 制备无水AlCl3时,加入的SOCl2只起脱水剂作用
B. 电池工作过程中, SOCl2被还原为Li2SO3和S单质
C. 电池工作过程中,电子经电解质溶液流向锂电极
D. 用该电池电解水,生成2mol H2,消耗1.5molSOCl2
难度: 困难查看答案及解析

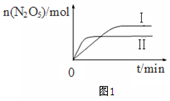



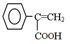 ,写出以
,写出以