-
以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料可制备金属镁和溴。流程如下:

(1)操作Ⅰ的名称是 ,所用主要玻璃仪器的名称是 。
(2)加入Ba2+的目的是 。用CaO调节溶液Y的pH,可以使Mg2+沉淀完全。由下表中数据可知,理论上选择pH范围是 。
| 开始沉淀时 | 沉淀完全时 |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-) =1.8mol/L |
(3)在空气中加热MgCl2·6H2O,可以生成Mg(OH)Cl,相应反应的化学方程式是 。
(4)化肥厂生产铵态氮肥(NH4)2SO4的部分流程如图:

向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和平衡移动角度分析) 。
-
以含有Ca2+、Mg2+、Clˉ、SO42ˉ、Brˉ 等离子的卤水为主要原料可制备金属镁和溴。流程如下:

(1)操作Ⅰ的名称是______,所用主要玻璃仪器的名称是_________、_________;需要选择的试剂是____________(填序号)。
a.乙醇 b.苯 c.四氯化碳 d.裂化汽油
(2)通氯气反应的离子方程式__________________________________。
(3)证明SO42ˉ完全沉淀的方法是______________________________。
(4)CaO用来调节溶液Y的pH,可以使Mg2+沉淀完全,由下表中数据可知,理论上应控制pH范围是__________。
| 开始沉淀时 | 沉淀完全时 |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-) =1.8mol/L |
(5)操作Ⅱ用下图所示操作______________实现(填“能”或“不能”)。原因是______________________________(用化学方程式解释)。
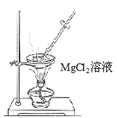
(6)工业上用惰性电极电解熔融状态下的氯化镁来冶炼镁,不能直接电解氯化镁溶液的原因是___________________________(用离子方程式表示)。
(7)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量NH4Cl晶体,充分振荡后浊液会变澄清,请用化学平衡的原理解释浊液变澄清的原因_________________________________。
-
实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
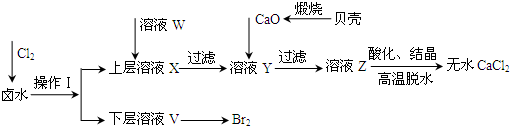
(1)操作Ⅰ使用的试剂是______,所用的主要仪器名称是______.
(2)加入溶液W的目的是______.用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择的pH最大范围是______.酸化溶液Z时,使用的试剂为______.
| 开始沉淀时的pH | 沉淀完全时的pH |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
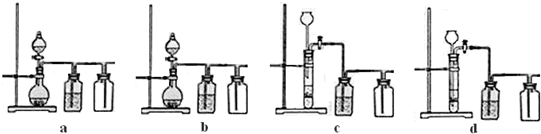
(3)实验室用贝壳与稀盐酸反应制备并收集气体,下列装置中合理的是______.
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11.某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测量溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3.该实验设计不正确,错误在于______.
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论).______.
仪器自选.
供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸.
-
实验室以含有Ca2+、Mg2+、Cl-、SO 、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
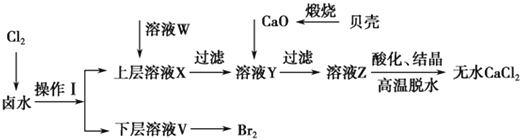
(1)操作Ⅰ使用的试剂是____________,所用主要仪器的名称是________。
(2)加入溶液W的目的是______________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是____________。酸化溶液Z时,使用的试剂为__________。
| 开始沉淀时的pH | 沉淀完全时的pH |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8 mol·L-1 |
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是__________。
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3的酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于___________________________。用一个化学方程式表示H2SO3酸性强于H2CO3: __________________。
-
实验室以含有 等离子的卤水为主要原料制备无水
等离子的卤水为主要原料制备无水 和
和 ,流程如下:
,流程如下:

(1)操作Ⅰ使用的试剂是________,所用主要仪器的名称是________。
(2)加入溶液W的目的是________。用CaO调节溶液Y的pH,可以除去 。由表中数据可知,理论上可选择pH最大范围是________ 。酸化溶液Z时,使用的试剂为 ________。
。由表中数据可知,理论上可选择pH最大范围是________ 。酸化溶液Z时,使用的试剂为 ________。

(3)实验室用贝壳与稀盐酸反应制备并收集 气体,下列装置中合理的是________。
气体,下列装置中合理的是________。

(4)常温下, 的电离常数
的电离常数 ,
, ,
, 的电离常数
的电离常数 ,
, 。某同学设计实验验证
。某同学设计实验验证 酸性强于
酸性强于 :将
:将 和
和 气体分别通入水中至饱和,立即用酸度计测两溶液的
气体分别通入水中至饱和,立即用酸度计测两溶液的 ,若前者的
,若前者的 小于后者,则
小于后者,则 酸性强于
酸性强于 。该实验设计不正确,错误在于________。
。该实验设计不正确,错误在于________。
设计合理实验验证 酸性强于
酸性强于 (简要说明实验步骤、现象和结论)。________。仪器器自选。
(简要说明实验步骤、现象和结论)。________。仪器器自选。
供选的试剂: 、
、 、
、 、
、 、
、 、
、 、蒸馏水、饱和石灰水、酸性
、蒸馏水、饱和石灰水、酸性 溶液、品红溶液、
溶液、品红溶液、 试纸。
试纸。
-
(18分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调
节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
②步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________、________、 NaOH。
③步骤2中,判断加入BaCl2已过量的方法是________
________________________。
(2)为检验精盐纯度,需配制100 mL 0.5mol/L(精盐)溶液,右图是该
同学转移溶液的示意图,图中的错误是
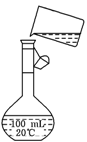
________________________________________________。
若在定容时仰视,则所配溶液的浓度_______0.5mol/L(填>或<)。
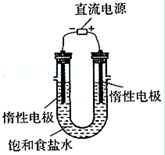
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
则相同条件下收集的Cl2(填>、=或<)
2L,原因________
(4)某学习小组设计了如下图实验,将氯气依次通过下列装
置以验证氯气的性质:
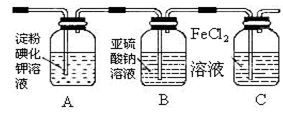
①通入氯气后,A中的现象是,整套实验装置存在的明显缺
陷是 。
②C装置中发生反应的离子方程式为。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
________
-
某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):
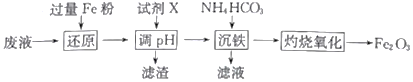
已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
| 金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
| 完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
-
某工厂酸性废液中含有Fe3+、Al3+、Fe2+、SO42-,以该废液为原料制备Fe2O3的工艺流程如下(部分操作和条件略):

已知:①NH4HCO3在热水中会分解。
②常温下,溶液中不同金属离子生成氢氧化物沉淀时的pH见下表:
| 金属离子(0.1mol·L-l) | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀时的pH | 2.4 | 7.6 | 3.4 |
| 完全沉淀时的pH | 3.7 | 9.6 | 4.8 |
回答下列问题:
(1)写出“还原”步骤中反应的离子方程式:_________________________________。
(2)试剂X可选用_________(任写一种,填化学式),“滤渣”的主要成分是_________________。
(3)加入碳酸氢铵后过滤,发现滤液仍然浑浊,可能的原因是_________________________,用90℃热水洗涤FeCO3沉淀的目的是______________________________________。
(4)若在实验室中灼烧FeCO3应在_____________(填仪器名称)中进行,“灼烧氧化”发生的化学方程式为__________________________________。
(5)若工业上灼烧氧化174.0吨FeCO3得到117.6吨产品,则该产品中Fe2O3的纯度为___________ (设产品中杂质只有FeO,保留一位小数)。
-
(15分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
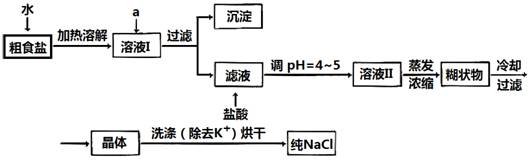
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_________________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪器除天平、药匙、玻璃棒外还有___ _____(填仪器名称)。
(3) 电解饱和食盐水的装置如图所示,
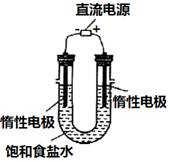
若收集的H2为2 L,
则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是__________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是_____________。
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:

-
(共16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
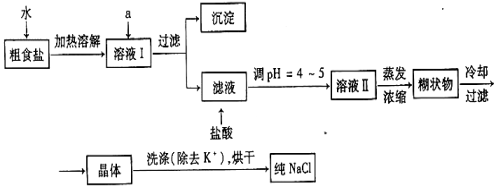
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为__________________(填化学式);滤液中滴加盐酸调PH=4-5的目的是
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量 KCl,检验NaCl是否洗净的方法是
(2)用提纯的NaCl配制480mL 0.40 mol·L-1NaCl溶液,需要称取NaCl的质量为 g,所用仪器除药匙、玻璃棒、烧杯外还有_____________(填仪器名称);
(3)电解饱和食盐水的装置如图所示,
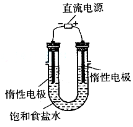
若收集的H2为2L,则同样条件下收集的Cl2 _____(填“>”、“=”或“<”)2L, 写出电解饱和食盐水的离子方程式




















