-
针对平衡2O2(g)+O2(g)
2SO2(g),采用下列措施一段时间后,能增大逆反应速率的是( )
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
难度: 简单查看答案及解析
-
如图表示的是某离子X的水解过程示意图,则离子X可能是( )

A.CO32- B.HCO3- C.Na+ D.NH4+
难度: 中等查看答案及解析
-
下列关于水的电离平衡的相关说法正确的是( )
A.c(H+)=
的溶液一定呈中性
B. 将水加热,Kw增大,pH增大,仍呈中性
C. 向0.1mol/L醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
D. 向水中加入少量碳酸氢钠固体,溶液的c(H+)增大,平衡逆向移动
难度: 中等查看答案及解析
-
在一定温度条件下,对于已达平衡的反应:FeCl3+3KSCN
3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是( )
A.加入少量氯化钾固体 B.加入少量氯化铁固体
C.只减少Fe(SCN)3的浓度 D.加水稀释
难度: 中等查看答案及解析
-
常温下测得某无色溶液中由水电离出c (H+)为10-13mol/L,该溶液中一定能大量共存的离子组是 ( )
A.K+、Na+、NO3-、SO42- B.K+、Na+、 Cl-、Cr2O42-
C.Al3+、K+、AlO2-、Cl- D.Fe3+、NO3-、S2O32-、NH4+
难度: 中等查看答案及解析
-
CaCO3在下列液体中溶解度最大的是( )
A.CaCl2溶液 B.Na2CO3溶液 C.稀盐酸 D.H2O
难度: 简单查看答案及解析
-
常温下将pH=9的Ba(OH)2溶液稀释500倍,稀释溶液后,c (OH -)与c (Ba2+)的比值近似为
A. 1 : 1 B.1 : 2 C.10 : 1 D.2 : 1
难度: 中等查看答案及解析
-
一定条件下的2L密闭容器,进行反应2X(g)+Y(g)
2Z(g),若起始时X、Y、Z物质的量分别为n1、n2、n3(均不为零)。达平衡时,X、Y、Z浓度分别为0.2mol/L、0.1 mol /L和0.08 mol/L,则下列判断合理的是( )
A. X和Y的转化率不一定相等
B. n1、n2=2:1
C. 平衡时,Y和Z的生成速率之比为2:1
D. n1的取值范围为0<n1<0.28
难度: 中等查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y、Z,发生反 应mX(g)
nY(g)+pZ(s) △H = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
下列说法正确的是( )
气体体积/L
c(Y)/mol•L-1
温度/℃
1
2
3
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
A.m>n+p
B.Q<0
C.温度不变,压强增大,Y的体积分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
难度: 困难查看答案及解析
-
将2molSO2、1molO2充入带活塞的密闭容器中,发生反应2SO2 (g) +O2(g)
2SO3 (g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是( )
A.保持溫度和容器的容积不变,充入2molSO2、1molO2
B.保持温度和容器的压强不变,充入1molSO3 (g)
C.其他条件不变的情况下改用绝热容器
D.保持温度和容器的压强不变,充入1molAr同时使用合适的催化剂
难度: 困难查看答案及解析
-
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)
xC(g),符合图象(I)所示关系。由此推断对图(II)的正确说法是( )

A.p3>p4,Y 轴表A的质量
B.p3>p4,Y轴表示混合气体平均摩尔质量
C.p3>p4,Y轴表示混合气体密度
D.p3<p4,Y轴表示B的百分含量
难度: 困难查看答案及解析
-
在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O=HCO3-+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡向正反应方向移动
C.升高溫度,
减小
D.加入NaOH固体,溶液pH减小
难度: 中等查看答案及解析
-
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示。下列说法正确的是( )
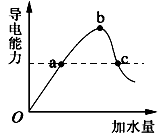
A.a、c两点pH不同
B.向c溶液中加水,溶液中所有离子浓度都减小
C.误用湿润的pH试纸测b点pH结果偏大
D.
b点大于c点
难度: 中等查看答案及解析
-
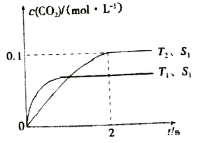
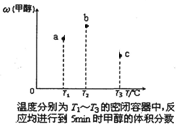
某化学科研小组研宄在其他条件不变时,改变某一条件对A2(g) +3B2 (g)
AB3 (g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度, n表示物质的景),根据如图可得出的判断结论正确的是( )
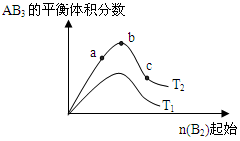
A.反应速率a>b>c
B.若T2>T1,则正反应一定是吸热反应
C.达到平衡时,AB3的物质的量大小为:b>c>a
D.达到平衡时A2的转化率大小为:b>a>c
难度: 困难查看答案及解析
-
从植物花中可提取一种简写为HIn的有机物,它在水溶液中因存在下列平衡: HIn(溶液,红色)
H+(溶液)+In-(溶液)而用作酸碱指示剂。向该溶液中加入Na2O2粉末,则溶液颜色为( )
A.红色变深 B.黄色变浅 C.黄色变深 D.褪为无色
难度: 中等查看答案及解析
-
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与 HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毐的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
难度: 中等查看答案及解析
-
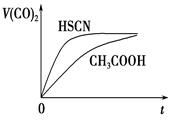
pH相同的等体积的两份溶液A和B; A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氧气的质量相同,则下列说法正确是的( )
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A = B
④反应过程的平均速率B>A
⑤盐酸里有锌剩余
⑥醋酸里有锌剩余
A.③④⑤ B.③④⑥ C.③④⑥ D.③④⑤⑥
难度: 中等查看答案及解析
-
常温下用0.02mmol/LNaOH溶液滴定0.01mol/L的H2SO4溶液中和后加水到100mL。若滴定时终点判断有误差:①多加了一滴NaOH,②少加了一滴NaOH(设1滴为0.05mL), 则①和②溶液中c(OH-)比值是( )
A.1 B.10-4 C.104 D.4×104
难度: 中等查看答案及解析
-
下列各表述与示意图—致的是( )
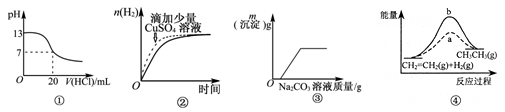
A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液, 溶液的pH随加入酸体积的变化
B.图②中表示常温下,两份少量等浓度的盐酸与过量锌粉反应时,其中一份滴加了少量硫酸铜溶液
C.图③表示10 mL 0.01 mol/LKMnO4酸性溶液与过量的0.1 mol/L H2C2O4溶液混合时(Mn2+是该反应的催化剂),n (Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) +H2(g) →CH3CH3 (g)△H < 0,使用和未使用催化剂时,反应过程中的能量变化
难度: 极难查看答案及解析
-
电离度是描述弱电解质电离程度的物理量,电离度=(己电离的电解质的物质的量/原来电解质总的物质的量) ×100%。现取 20mL pH=3的 CH3COOH 溶液,加入0.2mol/L的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
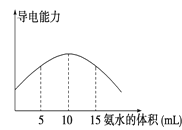
A.0.5% B.1.5% C.0.1% D.1%
难度: 困难查看答案及解析
-
加热N2O5依次发生的分解反应为:
①N2O5(g)
N2O3(g)+O2(g)
②N2O3(g)
N2O(g)+O2(g)
在容积为2L的密闭容器中充入8mol N2O5 (g),加热到t℃,达到平衡状态后,O2为9mol, N2O3 为3.4mol,则t‘C时反应①的平衡常数为( )
A.10.7 B.8.5 C.9.6 D.10.2
难度: 困难查看答案及解析
-
现有常温下的四种溶液(如下表),下列有关叙述正确的是( )
①
②
③
④
氨水
氢氧化钠
醋酸
盐酸
pH
11
11
3
3
A.分别加水稀释10倍,四种溶液的pH为:①>②>③>④
B.温度上升10℃,四种溶液的pH不变
C.③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变
D.将①④两种溶液等体积混合,所得溶液中c (C1-) >c NH4+)>c (H+)>c (OH- )
难度: 中等查看答案及解析
-
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.
<1.0×10-7mol/L
B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)
D.c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-)
难度: 困难查看答案及解析