-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W难度: 中等查看答案及解析
-
下列说法正确的是( )
A.糖类、油脂、蛋白质在一定条件下能水解
B.煤经过气化、液化等物理变化可得到清洁燃料
C.煤的干馏、石油裂化、石油裂解都是化学变化
D.棉花、羊毛、蚕丝、麻都由C、H、O元素构成难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.常温常压下,33.6L氯气与足量的铝充分反应,转移电子数为3NA
B.标准状况下,22.4LCH4分子中质子总数为10NA
C.室温下,28g乙烯和丙烯的混合物中含有的碳原子数为NA
D.1mol•L-1的Na2CO3溶液中所带钠离子总数为2NA难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.碳酸氢钙溶液跟稀硝酸反应 HCO3-+H+=H2O+CO2↑
B.饱和石灰水跟稀硝酸反应 Ca(OH)2+2H+=Ca2++2H2O
C.向稀氨水中加入稀盐酸 OH-+H+=H2O
D.碳酸钙溶于醋酸中 CaCO3+2H+=Ca2++H2O+CO2↑难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g)
2NH3 (g)△H<0.下列分析正确的是( )
A.平衡后加入N2,该反应的△H增大
B.若平衡后升高温度,则平衡常数K变大
C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大
D.若反应前充入的N2与H2物质的量相等,达平衡时N2的转化率比H2的高难度: 中等查看答案及解析
-
常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
A.该溶液中由水电离出的c(H+)=1×10-13mol•L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol•L-1HA溶液与0.05mol•L-1NaOH溶液等体积混合后所得溶液中c(H+)+c(Na+)=c(OH-)+c(A-)难度: 中等查看答案及解析
-
电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0.1mol Fe(OH)3沉淀时,共消耗amol H2O,产生bLH2(标准状况).则a和b分别为( )
A.a=0.25,b=2.24
B.a=0.05,b=2.24
C.a=0.25,b=4.48
D.a=0.3,b=3.36难度: 中等查看答案及解析
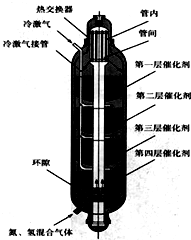
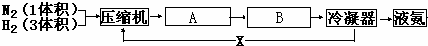 (1)写出设备A、B的名称:A______,B______;沿X路线进入压缩机的物质是______.
(1)写出设备A、B的名称:A______,B______;沿X路线进入压缩机的物质是______.