-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol/L,c(HI)=3 mol/L,则此温度下反应①的平衡常数为
A.9 B.16 C.12 D.25
难度: 中等查看答案及解析
-
在一密闭容器中,用等物质的量的A和B发生如下反应A(g)+2B(g)
2C(g),反应达到平衡时,若混合气体中A 和B的物质的量之和与C的物质的量相等,则这时A的转化率为
A.40% B.50% C.60% D.70%
难度: 中等查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A 和2 mol B进行如下反应:3A(g)+2B(g)
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A.该反应的化学平衡常数表达式是k=
B.此时B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,平衡向右移动,B的平衡转化率增大
难度: 中等查看答案及解析
-
反应Fe(s) +CO2 (g)
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=
C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D.该反应的正反应是放热反应
难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/( mol·L−1)
0.1
0.2
0
平衡浓度/( mol·L−1)
0.05
0.05
0.1
下列说法正确的是
A.反应达到平衡时,X和Y的转化率相等
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应可表示为X+3Y
2Z,其平衡常数为1600
D.若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
难度: 中等查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
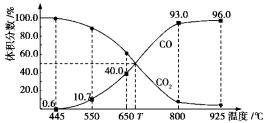
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
难度: 中等查看答案及解析