-
绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中的电能、氢能等。下列能源属于绿色能源的是( )
①太阳能;②风能;③石油;④煤;⑤潮汐能;⑥木材。
A、①②③ B、③④⑤
C、④⑤⑥ D、①②⑤
难度: 简单查看答案及解析
-
已知4NH3 + 5O2 = 4NO + 6H2O,若反应速率分别用
、
、
、
表示,则正确的关系是( )
A、
=
B、
=
C、
=
D、
=
难度: 简单查看答案及解析
-
热化学方程式中化学式前面的计量数表示( )
A、分子数 B、原子个数
C、物质的质量 D、物质的量
难度: 简单查看答案及解析
-
在密闭容器中充入4mol SO2和3mol O2,在一定条件下建立平衡:2SO2(g) + O2(g) 2SO3(g) △H,若SO2的转化率为90%,则在此条件下,反应放出的热量为( )
A、3.6△H B、1.8△H
C、2△H D、0.9△H
难度: 简单查看答案及解析
-
一定温度下,对可逆反应A(g)+2B(g) 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A、单位时间内消耗a mol A,同时生成3a mol C
B、容器内压强不再变化
C、单位时间内消耗2a mol B,同时消耗3a mol C
D、混合气体的平均摩尔质量不再变化
难度: 简单查看答案及解析
-
化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项
化学反应
测量依据(单位时间内)
A
CO(g)+H2O(g)=CO2(g)+H2(g)
压强变化
B
Zn+H2SO4=ZnSO4+H2
H2体积
C
2NO2N2O4
颜色深浅
D
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
沉淀质量
难度: 简单查看答案及解析
-
下列各组物质中,前者为强电解质,后者为弱电解质的是( )
A、氯化钠,浓氨水 B、氢氧化钠,水
C、硫酸,硫酸钡 D、氯化银,二氧化硫
难度: 简单查看答案及解析
-
下列叙述中,不能用平衡移动原理解释的是( )
A、红棕色的NO2,加压后颜色先变深后变浅
B、高压比常压有利于合成SO3的反应
C、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D、黄绿色的氯水光照后颜色变浅
难度: 简单查看答案及解析
-
室温下对PH相同,体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A、中和两者,需要PH值相等的相同体积的NaOH溶液
B、稀释两者相同倍数后,PH值仍然相等
C、加适量的醋酸钠晶体后,两溶液的PH值均增大
D、加足量的锌充分反应后,两溶液中产生的氢气一样多
难度: 简单查看答案及解析
-
影响活化分子的百分数的因素有( )
①温度;②浓度;③压强;④催化剂;⑤接触面积
A、①② B、①②③④ C、①④ D、②④
难度: 简单查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g)平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积压缩为原来的一半,再达平衡时,测得A的浓度为0.9mol/L。下列有关判断正确的是( )
A、x+y<z B、平衡向正反应方向移动
C、B的转化率降低 D、C的体积分数减小
难度: 简单查看答案及解析
-
在2A+B=3C+4D反应中,表示该反应速率最快的是( )
A、V(A)=0.5mol/(
) B、V(B)=0.3mol/(
)
C、V(C)=0.8mol/(
) D、V(D)=1mol/(
)
难度: 简单查看答案及解析
-
下列热化学方程式的书写正确的是(△H的绝对值均正确)( )
A、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1367.0KJ/mol(燃烧热)
B、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq) △H=+57.3KJ/mol(中和热)
C、S(s)+O2(g)=SO2(g) △H=-269KJ/mol(反应热)
D、2NO2O2+2NO △H=+116.2KJ/mol(反应热)
难度: 简单查看答案及解析
-
对可逆反应:NO(g)+CO(g)
N2(g)+CO2(g) △H=-372.2KJ/mol达到平衡后,为提高该反应的反应速率和NO的转化率,以下采取的措施正确的是( )
A、加催化剂 B、升高温度
C、加入催化剂同时增大压强 D、降低温度
难度: 简单查看答案及解析
-
右图是298K时N2与H2反应过程中能量变化的曲线图。
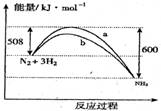
下列叙述不正确的是( )
A、该反应的热化学方程式为: N2(g)+3H2(g)2NH3(g),△H=92KJ·mol-1
B、b曲线是加入催化剂时的能量变化曲线
C、加入催化剂,该化学反应的活化能和反应热都改变
D、在温度体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为Q1 KJ,若通入2mol N2和 6mol H2反应后放出的热量为Q2 KJ,则184>Q2>2Q1
难度: 简单查看答案及解析