-
关于溶液的酸碱性说法正确的是
A.C(H+)很小的溶液一定呈碱性 B.pH=7的溶液一定呈中性
C.C(OH-)= C(H+)的溶液一定呈中性 D.不能使酚酞试液变红的溶液一定呈酸性
难度: 中等查看答案及解析
-
在同一温度下,当弱电解质溶液a,强电解质溶液b,金属导体c的导电能力相同,若同时升高到相同温度,则它们的导电能力是
A.a>b>c B.a=b=c C.c>a>b D.b>c>a
难度: 中等查看答案及解析
-
广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。根据上述观点,说法不正确的是
A.BaO2的水解产物是Ba(OH)2和H2O2 B.PCl3的水解产物是HClO和H3PO4
C.A14C3的水解产物是Al(OH)3和CH4 D.CH3COCl的水解产物是两种酸
难度: 中等查看答案及解析
-
下列有关滴定操作的顺序正确的是
①用标准溶液润洗滴定管
②往滴定管内注入标准溶液
③检查滴定管是否漏水
④滴定
⑤洗涤
A.⑤①②③④ B.⑤③①②④ C.⑤②③①④ D.②①③⑤④
难度: 中等查看答案及解析
-
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
A.白色沉淀为ZnS,而黑色沉淀为CuS
B.利用该原理可实现一种沉淀转化为更难溶的沉淀
C.该过程破坏了ZnS的溶解平衡
D.上述现象说明ZnS的Ksp小于CuS的Ksp
难度: 中等查看答案及解析
-
下列各组离子,在所给条件下一定能大量共存的是
A.pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42-
B.能和Ca2+生成沉淀的溶液中:Ba2+、K+ 、CH3COO-、Cl-
C.能使碘化钾淀粉试纸变蓝的溶液:Na+ 、NH4+、S2-、SO32-
D.由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3- 、Cl-
难度: 中等查看答案及解析
-
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
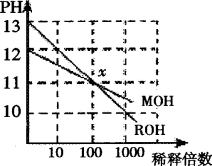
A.ROH是一种强碱 B.在x点,MOH并没有完全电离
C.在x点,c(M+)=c(R+) D.稀释前,c(ROH)=10c(MOH)
难度: 中等查看答案及解析
-
已知常温下BaSO4(分子量233)的溶解度为2.33×10-4g,则其Ksp为
A.2.33×10-4 B.1×10-5 C.1×10-10 D.1×10-12
难度: 中等查看答案及解析
-
用0.01mol·L-1 H2SO4 和0.01mol·L-1NaOH溶液,中和后加水至100mL。若在滴定时终点有误差:(1)多滴了1滴H2SO4;(2)少滴了1滴H2SO4(1滴为0.05 mL),则(1)和(2)两种情况下c(H+)之比的值是
A、10 B、50 C、5×103 D、104
难度: 中等查看答案及解析
-
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH) = 0时,c(H+)= 1× 10-2 mol/L
B.V(NaOH) < 10 mL时,不可能存在c(Na+) =2 c(C2O42-)+2 c(HC2O4-)
C.V(NaOH)> 10 mL时,c(H+)= 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-)
难度: 困难查看答案及解析
-
常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是
A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A.pH = 2 的HA溶液与pH=12的MOH溶液任意比混合c(H+) + c(M+)=c(A-) + c(OH-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合c(CH3COO-) + 2c(OH-) = 2c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2-)
难度: 困难查看答案及解析
-
某温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
难度: 中等查看答案及解析
-
在常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(A-)=c(K+)
B.c(H+)=c(OH-)<c(K+)<c(A-)
C.V总≧20mL
D.V总≦20mL
难度: 中等查看答案及解析