-
(12分)工业上制备氯化铜时,是将浓盐酸用水蒸汽加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO + 2HCl=CuCl2 + H2O ,FeO + 2HCl = FeCl2 + H2O。
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;
pH≥4.4时,Cu2+以Cu(OH)2的形式开始沉淀; pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中Fe2+,可采用的方法是 。
(2)工业上为除去溶液中的_________。溶液的pH变化是 。
(3)若此溶液只含Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入 。
(4)已知溶液中c(Cu2+)与溶液pH的关系为lg c(Cu2+)=8.6-2pH,若溶液中c(Cu2+)为1 mol/L,要保证此溶液中Cu2+刚好不发生Cu(OH)2沉淀,则溶液pH应为___________,此时溶液中的铁离子能否沉淀完全_________(填“能”或“否”)。
高二化学填空题困难题查看答案及解析
-
工业上制备氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下: CuO+2HCl=CuCl2+H2O;FeO+2HCl=FeCl2+H2O。已知: 当pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀; pH≥6.4时, Cu2+以Cu(OH)2形式完全沉淀;pH在3~4时, Fe3+以Fe(OH)3形式完全沉淀。除去溶液中的Fe2+可以采用的方法是
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化Fe3+成再调整pH至3~4
D.通入硫化氢,使Fe2+直接沉淀
高二化学选择题困难题查看答案及解析
-
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
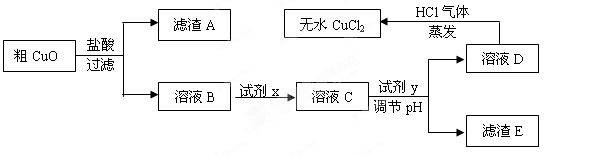 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=________。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是________
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是________(填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为________。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是________(填以下选项序号),原因是________。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是________。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于
mol
C.粗CuO中所含的铜元素的质量分数为
×100℅
D.粗CuO中关于CuO的量无法确定
高二化学填空题简单题查看答案及解析
-
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下:
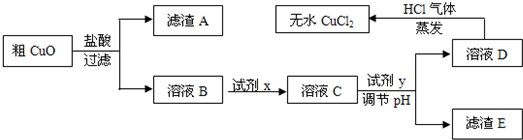
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38.试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=______.
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是______.
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是______(填以下选项序号).
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为______.
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是______(填以下选项序号),原因是______.
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是______.(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于B.粗CuO中CuO物质的量小于
mol
C.粗CuO中所含的铜元素的质量分数为x100%
D.粗CuO中关于CuO的量无法确定.高二化学解答题中等难度题查看答案及解析
-
在pH为4~5的环境中,Cu2+ 、Fe2+ 不能生成沉淀,而Fe3+几乎完全沉淀。工业上制取CuCl2 是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解,欲除去溶液中的杂质离了,下列方法正确的是
A.加入纯Cu将Fe2+ 还原
B.向溶液中加入(NH4)2S 使Fe2+沉淀
C.直接加水加热使杂质离子水解除去
D.在溶液中通入Cl2 ,再加入CuO粉末调节pH为4-5
高二化学选择题中等难度题查看答案及解析
-
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解.欲除去溶液中的杂质离子,下述方法中可行的是( )
A.向溶液中加入纯Cu将Fe2+还原
B.向溶液中通入H2S使Fe2+沉淀
C.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
D.在溶液中通入Cl2,再通入NH3调节pH为4~5高二化学选择题中等难度题查看答案及解析
-
工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤。请回答以下问题:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
Fe3+
Fe2+
Cu2+
氢氧化物开始沉淀时的pH
1.9
7
4.7
氢氧化物沉淀完全时的pH
3.2
9.6
6.7
(1)将浓盐酸溶解粗CuO粉末后,溶液中的金属阳离子含有___________,第一步除去该溶液中的Fe2+,能否直接调整溶液pH=9.6,将Fe2+沉淀除去?_____,(填“能” 或“不能”)理由是 _____________________________________________________________
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的pH将Fe3+沉淀除去:你认为用NaClO作氧化剂是否妥当?_____(填“是” 或“否”),现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个,填代号,下同)。
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)①加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的___________。
A.CuO B.NH3·H2O C.NaOH D.Cu(OH)2
②加上述物质调节溶液的pH为3.2~4.7,原因是________________________________________________
(4)最后能不能直接将溶液蒸发得到CuCl2·2H2O?______(填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O____________________________________________(若填“能”,此空不用回答)
高二化学综合题困难题查看答案及解析
-
(4分)工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? (填“是”或“否”),理由是 。
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有 。(多选)
A.NaOH
B.氨水
C.Cu2(OH)2CO3
D.Na2CO3
E.CuO
F.Cu(OH)2
高二化学填空题中等难度题查看答案及解析
-
工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。
请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?___,理由是___。
(2)有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是____。(填序号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?___,理由是___。
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有___(多选)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有___(多选)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
高二化学填空题中等难度题查看答案及解析
-
工业制备氯化铜时,将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整溶液pH=9.6,将Fe2+沉淀除去?________,(填“能” 或“不能”)理由是________,
(2)有人用强氧化剂NaClO先将Fe2+氧化为Fe3+,再调整溶液的PH将Fe3+沉淀除去:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?________,(填“是” 或“否”)现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个,填代号)。
A.浓HNO3 B.Cl2 C.KMnO4 D.H2O2
(3)加入适当物质调整溶液pH,使Fe3+转化为Fe(OH)3沉淀,可以达到除去Fe3+而不损失CuCl2的目的,则调整溶液pH可选用下列物质中的___________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
高二化学填空题困难题查看答案及解析