-
关于现行的元素周期表的说法正确的是
A.元素周期表有7个周期 B.元素周期表有8个主族
C.短周期是指第一、二周期 D.IA族的元素全部是金属元素
难度: 中等查看答案及解析
-
我国酸雨形成的主要原因是
A.汽车排出的大量尾气 B.自然界中硫化物的分解
C.工业上大量燃烧含硫的燃料 D.制硝酸厂排出的大量尾气
难度: 简单查看答案及解析
-
下列化合物中,不能由单质直接化合而得到的是
A.SiO2 B.HCl C.FeCl2 D.NO
难度: 中等查看答案及解析
-
将过量的CO2通入下列溶液中,最后能产生沉淀的是
A.硅酸钠溶液 B.石灰水 C.氯化钡溶液 D.氯化钙溶液
难度: 中等查看答案及解析
-
新制氯水与久置的氯水相比较,下列结论不正确的是
A.颜色相同 B.前者能使有色布条褪色
C.都含有H+ D.加AgNO3溶液都能生成白色沉淀
难度: 中等查看答案及解析
-
Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获1998年诺贝尔医学及生理学奖。关于NO的下列叙述中不正确的是
A、NO可以是某些含低价N物质氧化的产物 B、NO难溶于水
C、NO可以是某些含高价N物质还原的产物 D、NO是红棕色气体
难度: 简单查看答案及解析
-
用氯气给自来水消毒,某学生用自来水配制下列物质的溶液,药品不会产生明显变质的是
A.石蕊 B.硝酸银 C.亚硫酸钠 D.氯化铝
难度: 中等查看答案及解析
-
在制造玻璃和水泥都用到的原料是
A.石灰石 B.纯碱 C.黏土 D.石英
难度: 简单查看答案及解析
-
亚硝酸(HNO2)参加反应时,既可作氧化剂,也可作还原剂。当它作还原剂时,可能生成的产物
A.NH3 B.N2 C.N2O3 D.HNO3
难度: 简单查看答案及解析
-
已知反应①2BrO3- + Cl2 =Br2 +2ClO3- ②5Cl2 + I2 +6H2O=2HIO3 +10HCl
③ClO3- +5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是
A.ClO3->BrO3->IO3->Cl2 B.BrO3- >Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3- D.Cl2>BrO3->C1O3->IO3-
难度: 中等查看答案及解析
-
SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质
A.立刻褪色 B.慢慢褪色
C.先褪色,后复原 D.颜色不褪
难度: 中等查看答案及解析
-
下列关于SO2的叙述,正确的是
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是硫酸的酸酐
C.SO2可用于杀菌、消毒等,因此可以放心食用用大量SO2加工过的食物
D.SO2具有漂白性,因而可以使石蕊试液褪色
难度: 中等查看答案及解析
-
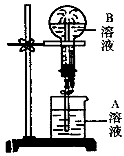
在下图所示的实验装置中,实验进行一段时间后,[对观察到的现象叙述不正确的是

A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出 D.蓝色石蕊试纸变红
难度: 中等查看答案及解析
-
在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是
A.K+、Na+、CO32-、NO3- B.NH4+、Al3+、SO42-、NO3-
C.NH4+、K+、MnO4-、SO42- D.Ca2+、Na+、NO3-、HSO3-
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷(CH4)的质量比为7︰4
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.Cl2能与金属活动顺序表中大多数金属反应
B.待测溶液中加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子
C.在用AgNO3溶液检验Cl-时,一般先在被检测的溶液中滴入少量的稀硝酸使其酸化,以排除干扰离子
D.硅是应用广泛的半导体材料,常温下化学性质不活泼,是光导纤维的主要成分
难度: 中等查看答案及解析
-
不能用磨口玻璃塞的试剂瓶盛装的溶液是
A.NaOH溶液 B.CuSO4溶液 C.AgNO3溶液 D.Na2SiO3溶液
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是
A. 氯气与水反应:Cl2 + H2O =2 H+ + Cl- + ClO-
B. 往FeCl3溶液中加入Fe粉:2Fe3++Fe=3Fe2+
C. 硅酸钠与盐酸反应:SiO32- + 2H+ = H2 SiO3↓
D. 三氧化硫与氢氧化钙溶液的反应:SO3 + 2OH— = SO42—+ H2O
难度: 中等查看答案及解析
-
将湿润的红色石蕊试纸放在进行下列实验的试管口,试纸变蓝色的有
A.加热浓氨水 B.加热NH4Cl固体
C.加热NH4Cl和Ca(OH)2的混合物 D.加热H2SO3溶液
难度: 中等查看答案及解析
-
关于硝酸的说法正确的是
A.硝酸与金属反应时,主要是+5价的氮得电子
B.浓HNO3与浓HCl按1∶3的体积比所得的混合物叫王水
C.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2
D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
难度: 中等查看答案及解析