-
下列有关有机物的说法中正确的是
A. 符合同一通式的有机物一定互为同系物
B. 乙烷不能使溴水和高锰酸钾溶液褪色
C. 所有的有机物都很容易燃烧
D. 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. CO2的电子式是:
B.
代表硝基苯的结构简式
C. 中子数为8的氮原子:
D. 模型
 可表示甲烷分子或四氯化碳分子
可表示甲烷分子或四氯化碳分子难度: 中等查看答案及解析
-
石油中常因有少量硫醇而产生难闻的气味。硫醇是-SH与链烃基相连的含硫有机物,其性质与醇类有相似之处。但是,由于-SH的存在,也导致硫醇有一些醇类所没有的化学性质,例如硫醇能跟NaOH溶液反应生成盐,硫醇在空气中能被氧化等等。根据信息判断下列有关硫醇性质的比较正确的是
A. 沸点:C2H5SH >C3H7SH B. 酸性:C2H5SH < C2H5OH
C. 水溶性:C2H5SH < C2H5OH D. 还原性:C2H5SH > C2H5OH
难度: 中等查看答案及解析
-
下列对如右图所示分子的描述正确的是

A. 该物质的分子式为C25H21 B. 该物质所有氢原子均在同一平面上
C. 该物质的一氯代物有3 种 D. 此分子为苯的同系物
难度: 简单查看答案及解析
-
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生索C的含量,其化学方程式为:
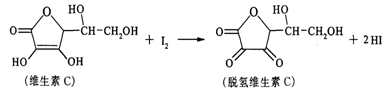
下列说法正确的是
A. 上述反应为取代反应 B. 维生素C的分子式为C6H9O6
C. 滴定时碘溶液盛放在碱式滴定管中 D. 滴定时可用淀粉溶液作指示剂
难度: 中等查看答案及解析
-
现有四种晶体,其离子排列方式如图所示,其中化学式不属AB型的是
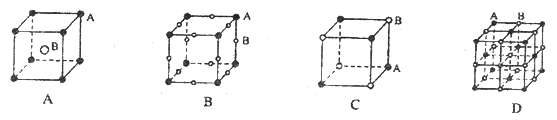
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于晶体结构的描述正确的是( )
A.冰中存在极性键、非极性键、范德华力、氢键
B.金属钾的晶胞空间利用率小于金属钋的晶胞空间利用率
C.36g金刚石晶体和36g石墨晶体含有的C—C数目相同
D.干冰的晶胞中CO2数目和金属铜的晶胞中Cu原子数目相同
难度: 中等查看答案及解析
-
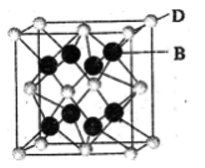
元素X的+1价离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法错误的是

A. X元素的原子序数是19 B. 该晶体中阳离子与阴离子个数比为3 : 1
C. X+离子是图中的黑球 D. X+的半径大于N3-
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2是含有极性键和非极性键的非极性分子
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2 + 6NaOH=2NaCl + Na2SO3+ Na2S+ 3H2O
D. S2Cl2的电子式为
难度: 困难查看答案及解析
-
己知lmol 链烃CxHy可以发生如下系列转化:
 (无机试剂是足量的)
(无机试剂是足量的)下列说法错误的是
A. Q的同分异构体数目少于CxH12
B. 用酸性高锰酸钾溶液可以区分CxHy和Q
C. 上述转化过程中依次发生了加成反应和取代反应
D. x=5、n=10
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L甲烷、戊烷混合物所含分子数为0.1NA
B. 0.1molC2H6O分子中含有的C-H的数目一定为0.5NA
C. 1L lmol/L的CH3COONa溶液中所含CH3COO-个数为NA
D. 标准状况下,2.24L16O2和3.6g18O2含有氧原子均为0.2NA
难度: 中等查看答案及解析
-
分子式为C4H7Cl的链状有机物的同分异构体(不考虑顺反异构)有
A. 7种 B. 8种 C. 9种 D. 10种
难度: 中等查看答案及解析
-
在探究下列物质性质或组成的实验中,实验现象与实验结论均正确的是
选项
实验内容
实验现象
实验结论
A
将几滴水加入蔗糖中并搅拌,再加入浓硫酸,迅速搅拌
蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质
只体现了浓硫酸的脱水性
B
将铜片放入浓硝酸中
产生大量红棕色气体,溶液变为蓝绿色
体现了浓硝酸的强氧化性和酸性
C
溴乙烷和氢氧化钠溶液充分反应,再加入硝酸银溶液
生成淡黄色沉淀
溴乙烷中含有溴元素
D
将溴水加入苯中并充分振荡
溴水褪色,下层有机层为橙红色
苯与溴水发生了萃取作用
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组微粒的空间构型相同的是
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2
⑤CO2和BeCl2 ⑥SiO44-和SO42- ⑦BF3和Al2Cl6
A.全部 B.除④⑥⑦以外 C.③④⑤⑥ D.②⑤⑥
难度: 困难查看答案及解析
-
类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中正确的是
A. Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
B. 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子
C. 可电解熔融MgCl2来制取金属镁;也能电解熔融AlCl3来制取金属铝
D. 第二周期元素氢化物稳定性顺序是HF>H2O > NH3;则第三周期元素氢化物稳定性顺序也是HCl> H2S > PH3
难度: 困难查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、M2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
难度: 困难查看答案及解析
-
下列有关说法不正确的是
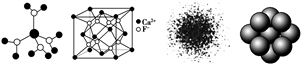
图1 图2 图3 图4
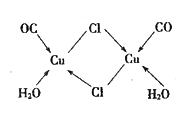
A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外的大多数电子在原子核附近运动
D. 金属Cu原子堆积模型如图4所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
难度: 困难查看答案及解析
-
高温下,超氧化钾晶体呈立方体结构,与NaCl晶体结构相似。晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法正确的是
A. 晶体中与每个K+距离最近的K+有6个
B. 晶体中每个K+周围有8个O2-,每个O2-周围有8个K +
C. 超氧化钾的化学式为KO2,每个晶胞含有14个K+和13个O2-
D. 晶体中,0价氧原子与-2价氧原子的数目比可看作为3 : 1
难度: 中等查看答案及解析