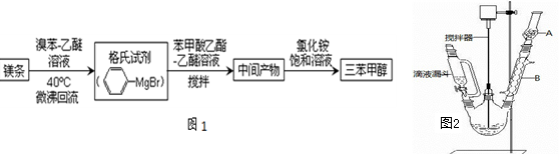
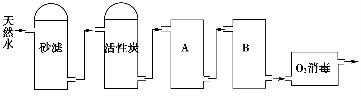
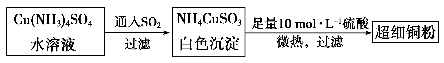
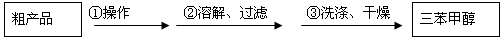-
下列说法正确的是 ( )
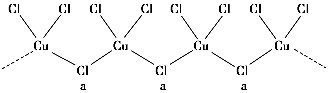
A.天然气和液化石油气的主要成分都是甲烷
B.甘氨酸和丙氨酸脱水,最多可生成3种二肽
C.古代的陶瓷、砖瓦,现代的有机玻璃、水泥都是硅酸盐产品
D.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于自来水的净化和杀菌消毒
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语正确的是( )
A.0.5mol/L氢氧化钙溶液和0.5mol/L碳酸氢镁溶液等体积混合反应:Ca2++ OH-+ HCO3=CaCO3↓+H2O
B.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO- = CaSO3↓+2HClO
C.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2=2Fe3++4Br2+10Cl-
D.某锂电池电极总反应为:4Li+2SOCl2 = 4LiCl+S+SO2↑,则正极反应为:2SOCl2 + 4e-= 4Cl-+S +SO2↑
难度: 中等查看答案及解析
-
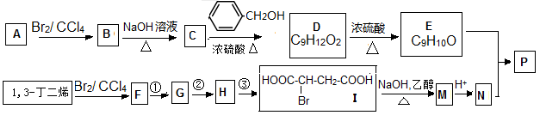
分子式为C5H12O的醇与和它相对分子质量相同的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)( )种
A.15 B.16 C.17 D.18
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.在高锰酸钾溶液中,H+、K+、SO42-、葡萄糖分子可以大量共存
D.已知:Ksp(AgCl)=1.8×10-10, Ksp(Ag2Cr2O4)=2.0×10-12,则Ag2CrO4的溶解度小于AgCl
难度: 困难查看答案及解析
-
为探究Fe2+ 对O3氧化I-反应的影响,某研究小组测定两组实验中I3-浓度和体系pH,结果见以下图表。
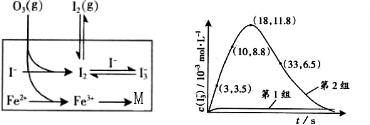
下列说法不正确的是( )
A.在溶液中存在化学平衡I2(aq) + I-(aq)
I3-(aq),其平衡常数表达式为
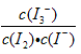
B.第2组实验进行18s后,由于I2(g)不断生成导致I3-浓度下降。
C.3-18s内第2组实验中生成I3-的平均反应速率约为0.55 mol/(L·s)
D. Fe2+可作为O3氧化I-的催化剂
难度: 中等查看答案及解析
-
4.6g铜镁合金完全溶解于100ml密度为1.40g/ml、质量分数为63%的浓硝酸中,得到4480mlNO2和336 ml N2O4 的混合气体(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液至离子恰好全部沉淀时,下列说法不正确的是 ( )
A.该合金中铜与镁的物质的量之比是46:69
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL
难度: 中等查看答案及解析
-
下列关于化学实验的“目的-操作-现象-结论”的描述不正确的是( )
实验目的 所加试剂(或操作、图示) 实验现象 实验结论
A 检验稀盐酸和氢氧化钠溶液是否恰好完全反应 在反应后的溶液中滴加无色酚酞试液 无明显现象 恰好完全反应
B 判断海水和蒸馏水 蒸发结晶 液体消失,无残留物 该液体为蒸馏水
C 检验溶液中是否含碳酸根离子或碳酸氢根离子 加入稀盐酸再将气体通入石灰水中 有无色无味气体产生,且石灰水中有白色浑浊形成 溶液中一定含碳酸根离子或碳酸氢根离子
D 测定空气中氧气的体积分数
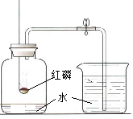 完全燃烧后,冷却至室温,打开弹簧夹,进入水的体积约为集气瓶中空气体积的1/5 氧气约占空气体积的1/5
完全燃烧后,冷却至室温,打开弹簧夹,进入水的体积约为集气瓶中空气体积的1/5 氧气约占空气体积的1/5难度: 中等查看答案及解析