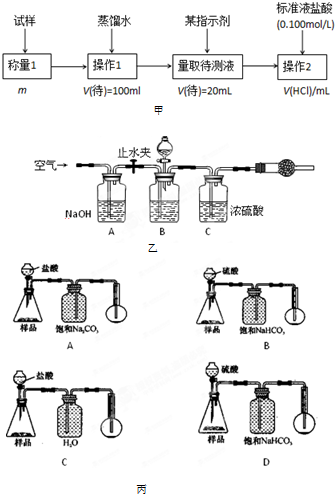
-
人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是( )
A.K
B.Ca
C.Na
D.Fe难度: 中等查看答案及解析
-
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量难度: 中等查看答案及解析
-
镭是元素周期表中第七周期的ⅡA族元素.下面关于镭的性质的描述中不正确的是( )
A.在化合物中呈+2价
B.单质与水反应放出氢气
C.氢氧化物呈两性
D.镭的还原性大于镁难度: 中等查看答案及解析
-
松江正在进行生活垃圾分类.生活垃圾中的塑料袋、废纸、旧橡胶制品等属于( )
A.无机物
B.有机物
C.盐类
D.非金属单质难度: 中等查看答案及解析
-
元素性质呈周期性变化的根本原因是( )
A.核外电子排布呈周期性变化
B.元素的相对原子质量逐渐增大
C.核电荷数逐渐增大
D.元素化合价呈周期性变化难度: 中等查看答案及解析
-
氢氧化铝可作为治疗胃酸过多的药物,其原因主要是利用氢氧化铝的( )
A.酸性
B.碱性
C.两性
D.氧化性难度: 中等查看答案及解析
-
下列关于铝的叙述中正确的是( )
A.铝的导电性比铜、银更强
B.铝不易与氧气化合
C.铝能溶解于冷的浓硝酸
D.通过铝热反应可冶炼高熔点金属难度: 中等查看答案及解析
-
加热时必须隔着石棉网的是( )
A.试管
B.坩埚
C.烧杯
D.蒸发皿难度: 中等查看答案及解析
-
右图是石油分馏塔的示意图,a、b、c三种馏分中( )

A.a的沸点最高
B.b的熔点最低
C.c的平均分子量最大
D.每一种馏分都是纯净物难度: 中等查看答案及解析
-
常见的永久磁铁的组成为BaFe12O19,与曾用于雷达微波过滤器的钇铁榴石Y3Fe5O12均为铁氧体,Y为稀土元素,常为+3价.则两物质组成中所含铁元素的化合价为( )
A.只有+2价
B.只有+3价
C.+2和+3价
D.+2和+6价难度: 中等查看答案及解析
-
二氟甲烷(CH2F2)是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库等压缩机中的制冷剂.二氟甲烷的分子结构有( )
A.1种
B.2种
C.3种
D.4种难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.铁与稀硫酸反应2Fe+6H+→2Fe3++3H2↑
B.铝盐溶液与氨水反应Al3++3OH-→Al(OH)3↓
C.碳酸钙与稀盐酸反应CO32-+2H+→CO2↑+H2O
D.铁与氯化铁溶液反应Fe+2Fe3+→3Fe2+难度: 中等查看答案及解析
-
p克某结晶水合物A•nH2O,受热失去全部结晶水后,质量变为q克,由此可以得知该结晶水合物的相对分子质量为( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
在某溶液中加入酚酞试液后呈红色,则下列离子在溶液中不能大量存在的是( )
A.Fe3+
B.Na+
C.Ba2+
D.AlO2-难度: 中等查看答案及解析
-
下列关于周期表中元素分界线的叙述中正确的是( )
A.通常用来制农药的元素,在分界线附近
B.制半导体材料的元素,位于分界线的左下方
C.分界线两侧的元素中,可用作催化剂或制耐高温材料
D.周期表中分界线,把表中元素分成金属和非金属两个区域难度: 中等查看答案及解析
-
某有机物在氧气中充分燃烧,只生成水蒸气和二氧化碳,且两者物质的量之比为1:1,由此可以得出的结论是( )
A.可以推算出该有机物的化学式
B.分子中C、H原子个数之比为1:2
C.分子中C、H原子个数之比为1:1
D.分子中必定含氧原子难度: 中等查看答案及解析
-
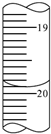
图为元素周期表的一部分(数字为原子序数),其中X元素的原子序数为35的是( )
A.
B.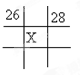
C.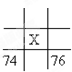
D.难度: 中等查看答案及解析
-
已知元素的原子序数,可以推断原子的( )
①质子数; ②中子数; ③最外层电子数; ④核电荷数; ⑤核外电子总数; ⑥相对原子质量.
A.①③④⑤
B.①②④⑤
C.①④⑤⑥
D.①②③⑤难度: 中等查看答案及解析
-
如图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,下说法中不正确的是( )
A.原子半径大小顺序是c>b>d>a
B.d的氢化物比a的氢化物稳定
C.a和d的原子结合可以形成带3个负电荷的阴离子
D.a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a难度: 中等查看答案及解析
-
将氨水逐渐加入到物质的量浓度相等的AlCl3和MgCl2的混合溶液中至过量,生成沉淀的物质的量和所加氨水的体积的关系如图,正确的是( )
A.
B.
C.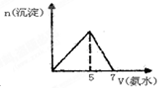
D.
难度: 中等查看答案及解析
-
某元素最高价氧化物化学式为RO2,其中R元素的质量分数为27.27%.对此元素叙述正确的是( )
A.该元素是第二周期ⅣA族的元素
B.该元素所形成的气态氢化物中含H量一定为25%
C.RO2与水反应能生成强酸
D.石油的成分主要是该元素与氢形成的化合物难度: 中等查看答案及解析
-
某次硫酸铜晶体结晶水含量的测定实验中,相对误差为-2.67%,其原因可能是( )
A.实验时盛放硫酸铜晶体的容器未完全干燥
B.加热过程中晶体有少量溅失
C.硫酸铜晶体中含有不分解失重的杂质
D.加热后固体未放入干燥器中冷却难度: 中等查看答案及解析
-
镁铝合金m g和足量盐酸反应后得到的气体在标准状况下的体积为2.24L,m的数值可能是( )
A.1.8
B.2.0
C.2.2
D.2.4难度: 中等查看答案及解析
-
下列事实能说明碳与硫两元素非金属性相对强弱的有( )
A.同条件同浓度溶液pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
D.分解温度:CH4>H2S难度: 中等查看答案及解析
-
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )

A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B.b点溶液的中c(Na+)=c(C1-)
C.b-c段与c-d段溶液中阴离子的物质的量相等
D.在d点,向溶液中加入少量盐酸,沉淀量将减少难度: 中等查看答案及解析