-
A、B、C、D、E五种元素的原子序数逐渐增大,且均不超过18.其中A与C、B与E分别为同族元素.原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等.下列说法正确的是( )
A.原子电子层数:A<B
B.气态氢化物的稳定性:B<E
C.简单离子半径:E<D
D.最高价氧化物对应的水化物碱性:C<D难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素难度: 中等查看答案及解析
-
R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R、M的最高价氧化物水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强
B.HnJOm为强酸,则G是位于VA族以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若M的最高正化合价为+4,则五种元素都是非金属元素难度: 中等查看答案及解析
-
根据表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价元素代号 L M Q R T 原子半径/nm 0.160 0.143 0.112 0.104 0.066 主要化合价 +2 +3 +2 +6、-2 -2
A.氢化物的沸点为H2T>H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A.HF的电子式:
B.Cl-的结构示意图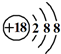
C.CH4分子的比例模型:
D.质量数为37的氯原子1737Cl难度: 中等查看答案及解析
-
下列说法正确的是( )
A.第二周期元素的第一电离能随原子序数递增依次增大
B.卤族元素中氟的电负性最大
C.CO2、SO2都是直线型的非极性分子
D.CH2=CH2分子中共有四个σ键和一个π键难度: 中等查看答案及解析
-
“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
A.ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子
D.干冰(CO2)是分子晶体,则SiO2也是分子晶体难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中错误的是( )
A.Y的气态氢化物的稳定性较Z的强
B.原子半径:W>Z>Y>X
C.最高价氧化物的水化物酸性W较Z强
D.四种元素的单质中,Z的熔沸点最高难度: 中等查看答案及解析
-
美国科学家设想“绿化”火星并使其成为第二个地球:火星上造超级温室气体.美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
A.分子中三个碳原子可能处于同一直线上
B.全氟丙烷的电子式为:
C.相同压强下,沸点:C3F8<C3H8
D.全氟丙烷中及既有极性键又有非极性键难度: 中等查看答案及解析
-
下列结论正确的是( )
①微粒半径:Fe(OH)3胶粒>S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:Fe3+>Cu2+>Fe2+>Zn2+ ④单质氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥熔沸点:Na>H2O>HF>HCl.
A.①②④
B.②④⑥
C.只有①
D.只有⑥难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,3.2gO3所含电子数为1.2NA
B.标准状况下,11.2L氯仿(CHCl3)中含有的C-Cl键的数目为1.5NA
C.0.4gC3H4中含有共用电子对的数目为0.1NA
D.0.25molNa2O2中含有的阴离子数为0.5NA难度: 中等查看答案及解析
-
如图是元素周期表的一部分,下列说法中正确的是( )
A.元素①位于第二周期第VA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物酸性:⑤>④
D.元素的最高正化合价:③=⑤难度: 中等查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E同主族,B与 F同主族,E与F同周期.已知常温下单质A与E的状态:不同,D原子的核电荷 数是B原子最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
A.由A、C、D三种元素组成的化合物一定是共价化合物
B.F与D形成的化合物性质很不活泼,不与任何酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.元素的非金属性由强到弱的顺序是:D>C>F>B难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.1个甘氨酸分子(结构式如图)中存在10对共用电子
B.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
C.H2S和CS2分子都是含极性键的极性分子
D.甘氨酸分子(结构式如图)中C原子有sp3、sp2两种杂化方式
难度: 中等查看答案及解析