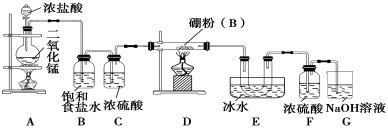
-
化学与人类生活、生产和社会可持续发展密切相关。下列说法正确的是
A.在食品袋中放入盛有硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质
B.为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏
C.白酒标签上注有“酒精度52%Vol”字样,它表示100g该白酒中含有52g酒精
D.回收废弃塑料制成燃油或回收地沟油制生物柴油,可减轻环境污染和节约化石能
难度: 中等查看答案及解析
-
下列选项操作错误或不能达到实验目的的是
A.可用25ml酸式滴定管量取20.00ml KMnO4溶液
B.从碘水中提取单质碘,不能用无水乙醇代替CCl4
C.石蕊试纸和PH试纸使用前用蒸馏水润湿
D.CO2中混有少量SO2,除杂试剂和方法为:KMnO4(H+)、浓硫酸,洗气
难度: 中等查看答案及解析
-
下列说法正确的是
A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS)
B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大
C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体
D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀
难度: 中等查看答案及解析
-
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是
A.与W相邻的同主族元素可制成重要的半导体材料
B.元素原子半径从大到小的顺序是X、Y、Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D.W、Y、Z元素对应的氢化物稳定性最强的是H2Y
难度: 中等查看答案及解析
-
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是
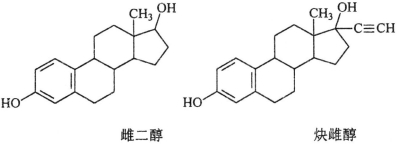
A.核磁共振氢谱峰数相同
B.均能发生加成反应、取代反应、消去反应
C.两种分子中所有碳原子不可能在同一个平面内
D.可用FeCl3溶液鉴别
难度: 中等查看答案及解析
-
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH—)=2c(H+)+c(HA)-c(A—)
B.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2—)+c(HR—)=c(Na+)
D.某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则该溶液的pH一定为14-a
难度: 中等查看答案及解析
-
用CH4催化还原NOx可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H=-574 kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ/mol
③H2O(g)=H2O(l) △H=-44kJ/mol。下列说法不正确的是
A.等物质的量的CH4参加反应,反应①②转移的电子数相同
B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-530 kJ/mol
C.0.2 mol CH4还原NO2至N2,且生成H2O(g)放出的热量为164.6 kJ
D.若用4.48 L(标准状况)CH4还原NO2至N2且生成H2O(g),整个过程中转移电子1.60 mol
难度: 中等查看答案及解析