-
食品添加剂关系到大家健康,下列物质中的添加剂作用不正确的是
A
B
C
D




防治高血压
防治缺铁性贫血
做甜味剂
做防腐剂
难度: 简单查看答案及解析
-
下列与处理方法对应的反应方程式不正确的是
A.工业上用水吸收NO2生产硝酸:3NO2 + H2O = 2HNO3 + NO
B.用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3+ + 3OH- = Fe(OH)3↓
C.用熟石灰处理泄漏的液氯:2Ca(OH)2 +2Cl2 = CaCl2 + Ca(ClO)2 +2H2O
D.用明矾除去水中的悬浮颗粒物:Al3+ + 3H2O
Al(OH)3(胶体) + 3H+
难度: 中等查看答案及解析
-
下列说法不正确的是
A.乙二醇用于汽车防冻液
B.麦芽糖在水解前后均能发生银镜反应
C.1-氯丙烷和2-氯丙烷发生消去反应的产物不同
D.H2N—CH2—COOH的缩聚产物中含
结构
难度: 中等查看答案及解析
-
依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物NH3、H2O、HF的稳定性
C.碱金属单质Li、Na、K与水反应的剧烈程度
D.1mol Na、Mg、Al分别与足量盐酸反应时失电子数的多少
难度: 中等查看答案及解析
-
下图为Pt电极的氢氧燃料电池工作原理示意图,H2SO4为电解质溶液。有关说法不正确的是
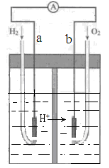
A.a极为负极,电子由a极流向b极
B.a极的电极反应式是:H2 -2e- = 2H+
C.电池工作一段时间后,装置中c(H2SO4)增大
D.若将H2改为等物质的量CH4,O2的用量增多
难度: 中等查看答案及解析
-
用氯气制取并获得碘单质,不能实现实验目的的装置是

A.用甲制取少量氯气 B.用乙氧化溶液中的碘离子
C.用丙提取置换出来的碘 D.用丁过滤I2的CCl4溶液得碘单质
难度: 中等查看答案及解析
-
根据下列实验及现象,能量关系正确的是
实验及现象
能量关系
A
将“NO2球”置于热水中,红棕色加深
N2O4(g)
2NO2(g) △H <0
B
NaOH与HCl溶液混合,溶液温度升高
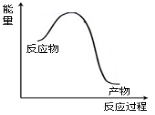
C
钠投入水中,熔化成小球

D
微热含酚酞的Na2CO3溶液,红色加深
CO32-(aq)+H2O(l)
HCO3-(aq)+OH-(aq)△H <0
难度: 中等查看答案及解析
-
在下列四个核反应方程中,符号“X”表示中子的是
A.
B.
C.
D.
难度: 简单查看答案及解析