-
下列关于化学与生活的叙述,不正确的是( )
A.学校在走道的铁栏杆新刷红色的漆,油漆里的红色颜料的主要成分是Fe2O3
B.用食醋除去茶壶的水垢,是利用了食醋中的醋酸的酸性
C.家用84消毒液,是利用其主要成分次氯酸或次氯酸盐的强氧化性消毒杀菌
D.市面上销售的加碘食盐,可以用滴加淀粉溶液检验碘的存在,现象是变蓝。
难度: 简单查看答案及解析
-
下列说法正确的的是( )
A.淀粉和纤维素的化学式都可以用(C6H10O5)n来表示,所以它们是同分异构体
B.用镍做催化剂,苯和氢气反应生成环己烷,发生的反应类型是取代反应
C.油脂在酸性条件下水解,生成的是甘油和高级脂肪酸
D.可逆反应的化学平衡移动,则该反应的平衡常数一定改变
难度: 简单查看答案及解析
-
下列有关实验的操作正确的是( )
实 验
操 作
A
提取碘水中的碘
向分液漏斗的碘水中加入无水酒精,充分振荡,然后分液
B
向试管滴加液体
胶头滴管紧贴试管内壁
C
加热试管内液体
用试管架夹住试管,手持试管夹,在酒精灯的外焰上加热
D
检验氢气的纯度
将氢气发生器的氢气导管,伸向酒精灯火焰上点燃
难度: 简单查看答案及解析
-
下列说法中,不正确的是( )
A.酸碱完全中和,也叫作酸碱完全反应,但是,反应后的水溶液不一定呈中性
B.用外加直流电源的阳极接船闸的,阴极接不溶性电极,如石墨电极,防止船闸腐蚀
C.在化学上,残留在溶液中的离子浓度小于1×10-5mol·L-1时,沉淀达到完全
D.在移动的钢铁船舶的外体放置锌块,减少船体的腐蚀,叫做牺牲阳极的阴极保护
难度: 中等查看答案及解析
-
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-===AgCl
B.每生成1 mol Na2Mn5O10 转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
难度: 中等查看答案及解析
-
A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大,A是原子半径最小的元素,A、D及B、E分别是同一主族元素,且B、E两元素的原子核中质子数之和是A、D两元素的原子核中质子数之和的2倍。下列说法中正确的是( )
A. 与A形成化合物的稳定性C>B>E
B. 形成简单离子的半径E>D>B
C. 单质B和D在常温下化合生成D2B2
D. C的最高价氧化物对应水化物的酸性最强
难度: 中等查看答案及解析
-
在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C 物质的量与时间的关系如图甲,C的百分含量与温度的关系如图乙。下列分析不正确的是( )

A.0~4 min时,A的平均反应速率为0.02 mol·L-1·min-1
B.该反应的平衡常数表达式K=
C.由T1向T2变化时,正反应速率大于逆反应速率
D.该反应正反应是放热反应
难度: 困难查看答案及解析


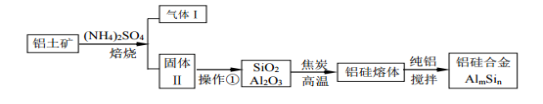
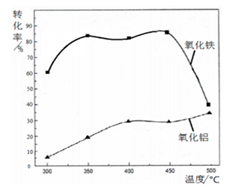
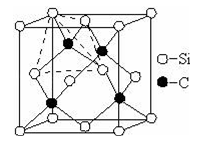
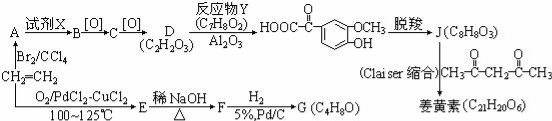
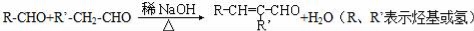
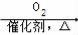 CH3COOH
CH3COOH  CH3COOCH2CH3
CH3COOCH2CH3 和乙醛为起始原料(其他无机试剂可任选),制备
和乙醛为起始原料(其他无机试剂可任选),制备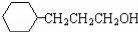 的合成路线:______________________。
的合成路线:______________________。