-
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”。
(1)高温固相法是磷酸铁锂生产的主要方法。通常以铁盐、磷酸盐和锂盐为原料,按化学计量比充分混匀后,在惰性气氛的保护中先经过较低温预分解,再经高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O4•2H2O+2NH4H2PO4═2NH3↑+3CO2↑+______+_______+_______
①完成上述化学方程式.
②理论上,反应中每转移0.15mol电子,会生成LiFePO4______________g;
③反应需在惰性气氛的保护中进行,其原因是______________;
(2)磷酸亚铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。
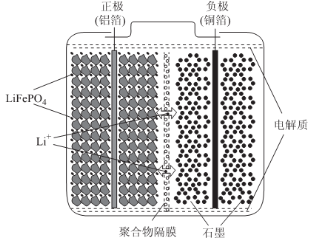
电池工作时的总反应为:LiFePO4+6C Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
Li1-xFePO4+LixC6,则放电时,正极的电极反应式为______________。充电时,Li+迁移方向为______________(填“由左向右”或“由右向左”),图中聚合物隔膜应为______________(填“阳”或“阴”)离子交换膜。
(3)用该电池电解精炼铜。若用放电的电流强度I=2.0A的电池工作10分钟,电解精炼铜得到铜0.32g,则电流利用效率为______________(保留小数点后一位)。(已知:法拉第常数F=96500C/mol,电流利用效率= 100%)
100%)
(4)废旧磷酸亚铁锂电池的正极材料中的LiFePO4难溶于水,可用H2SO4和H2O2的混合溶液浸取,发生反应的离子方程式为______________。
-
亚硝酸氯(C1NO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+C12(g) 2C1NO(g),
2C1NO(g),
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①2NO2(g)+NaC1(s) NaNO3(s)+ClNO(g)K1
NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaC1(s) 2NaNO3(s)+2NO(g)+Cl2(g)K2
2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+C12(g) 2C1NO(g)K3
2C1NO(g)K3
则K1,K2,K3之间的关系为K3=______________。
(2)已知几种化学键的键能数据如下表(亚硝酸氯的结构为Cl-N=O):

则2NO(g)+C12(g) 2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
2C1NO(g)反应的△H和a的关系为△H=______________kJ/mol。
(3)300℃时.2NO(g)+C12(g) 2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
2ClNO(g)的正反应速率表达式为v正=k·cn(ClNO),
测得速率和浓度的关系如下表:

n=____________;k=____________(注明单位)。
(4)在1L的恒容密闭容器中充入2molNO(g)和1molC12(g),在不同温度下测得c(C1NO)与时间的关系如图A:
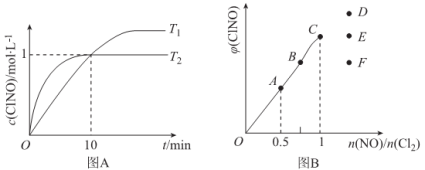
①该反应的△H____________0(填“>”“<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=____________mol/(L·min),
③T2时该反应的平衡常数K=____________
(5)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(C12)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是____________点,当n(NO)/n(C12)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____________点。
-
纯碱是一种非常重要的化学基本工业产品,工业上有很多不同的方法生产纯碱。
Ⅰ、路布兰法——其生产原理:用硫酸将食盐转化为硫酸钠,将硫酸钠与木炭、石灰石一起加热,得到产品和硫化钙。
(1)请写出上述过程的化学方程式:____________。
Ⅱ.索尔维制碱法:以食盐、氨气(来自炼焦副产品)和二氧化碳(来自石灰石)为原料,首先得到小苏打,再加热分解小苏打,获得纯碱。
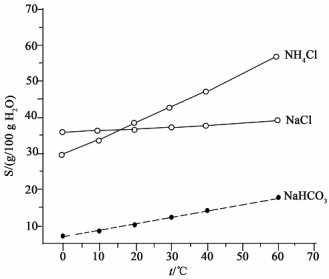
(2)结合下图中所给物质的溶解度曲线。写出得到小苏打的离子方程式:____________。
(3)这种生产方法的优点是原料便宜、产品纯度高、氨和部分二氧化碳可以循环使用。请写出实现氨循环的化学方程式:____________。
Ⅲ.侯德榜制碱法——生产流程可简要表示如下:
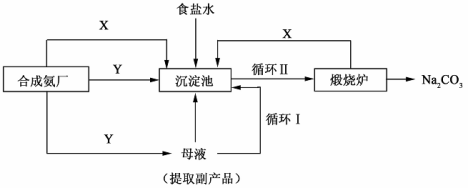
(4)合成氨工厂需要向制碱厂提供两种原料气体,其中Y是____________(填化学式),这两种气体在使用过程中是否需要考虑通入的先后顺序____________(填”是”或“否”),原因是____________。
(5)侯德榜制碱法保留了索尔维法的优点,克服了它的缺点,特别是设计了____________(填流程中的编号)使原料中溶质的利用率从70%提高到了96%以上。从母液中可以获得的副产品的应用:____________(举一例)。
(6)该合成氨厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其它损耗)的____________%(保留两位有效数字)。
-
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)基态亚铜离子中电子占据的原子轨道数目为____________。
(2)若基态硒原子价层电子排布式写成4s24px24py4,则其违背了____________。
(3)左下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是____________(填标号)。
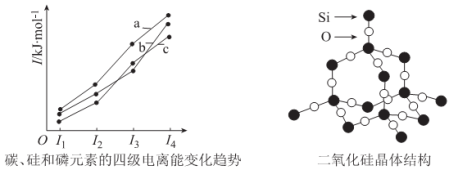
(4)单晶硅可由二氧化硅制得,二氧化硅晶体结构如右上图所示,在二氧化硅晶体中,Si、O
原子所连接的最小环为____________元环,则每个O原子连接____________个最小环。
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O.其结构如图所示,它的阴离子可形成链状结构。
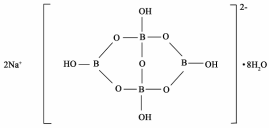
①该晶体中不存在的作用力是____________(填选项字母)。
A.离子键B.共价键C.金属键D.范德华力E.氢键
②阴离子通过____________相互结合形成链状结构。
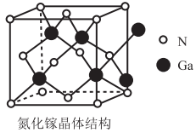
(6)氮化嫁(GaN)的晶体结构如图所示。晶体中N、Ga原子的轨道杂化类型是否相同____________(填“是”或“否”),判断该晶体结构中存在配位键的依据是____________。
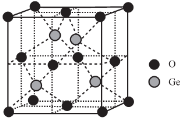
(7)某光电材料由锗的氧化物与铜的氧化物按一定比例熔合而成,其中锗的氧化物晶胞结构如下图所示,该物质的化学式为____________。已知该晶体密度为7.4g/cm3,晶胞边长为4.3×10-10m。则锗的相对原子质量为____________(保留小数点后一位)。
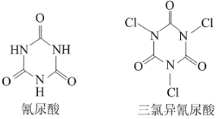

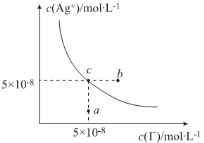
AgI(s)+Br-(aq)的平衡常数K=200

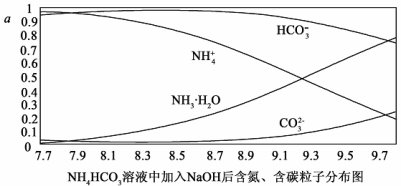












 (有弱碱性,易被氧化)。
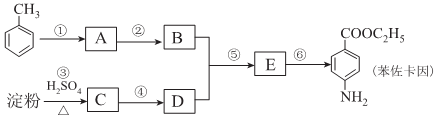
(有弱碱性,易被氧化)。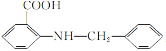 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图: