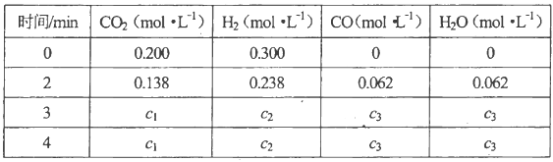
-
下列物质的水溶液中,除了水分子外,不存在其他分子的是( )。
A.HCI B.NH4NO3 C.Na2S D.HClO
难度: 中等查看答案及解析
-
已知298K时下述反应的有关数据:
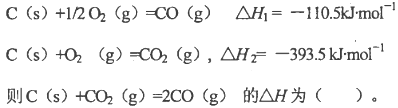

难度: 中等查看答案及解析
-
对“
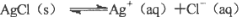 ”的理解正确的是( )。
”的理解正确的是( )。A.说明AgCl没有完全电离,AgCl是弱电解质
B.说明溶解的AgCl已完全电离,AgCl是强电解质
C.说明Ag+与Cl-的反应不能完全进行到底
D.说明Ag+与Cl-的反应可以完全进行到底
难度: 中等查看答案及解析
-
下列方程式属于水解反应方程式的是( )。
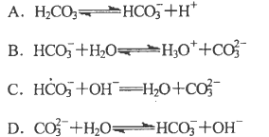
难度: 中等查看答案及解析
-
在
 反应中,表示该反应速率最快的是( )。
反应中,表示该反应速率最快的是( )。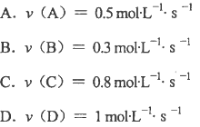
难度: 中等查看答案及解析
-
已知反应
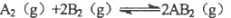 △H<O,下列说法正确的( )。
△H<O,下列说法正确的( )。A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
难度: 中等查看答案及解析
-
把Ca(0H)2放入蒸馏水中,—段时间后达到平衡:

下列说法正确的是( )。
A.向溶液中加CaO,并恢复原温度时,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(0H)2固体质量不变
难度: 中等查看答案及解析
-
下列事实可证明氨水是弱碱溶液的是( )。
A.氨水能被弱酸醋酸中和 B.铵盐受热易分解
C.氨水可以使酚酞试液变红 D.0.lmol/L氯化铵溶液的pH约为5
难度: 中等查看答案及解析
-
反应:
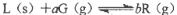 达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )。
达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )。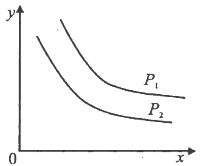
A.上述反应是放热反应 B.上述反应是吸热反应
C.a>b D.a+1<b
难度: 中等查看答案及解析
-
常温下,若使pH=3的盐酸与pH=9的Ba(0H)2溶液混合使其成为pH=7的溶液,混合时两溶液的体积比为( )。
A.1:60 B.3:1 C.100:l D.1:100
难度: 中等查看答案及解析
-
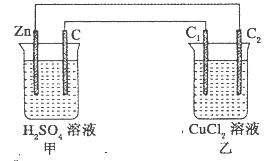
下列各装置中铜电极上能产生气泡的是( )。
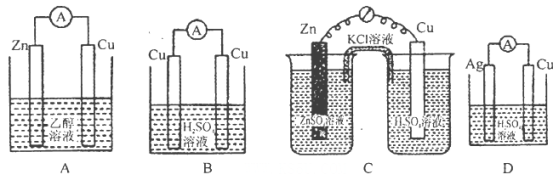
难度: 中等查看答案及解析
-
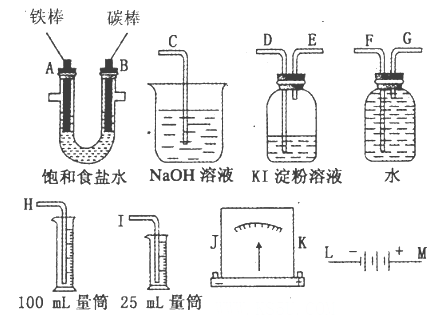
某同学按图所示的装置进行电解实验,下列说法错误的是( )。
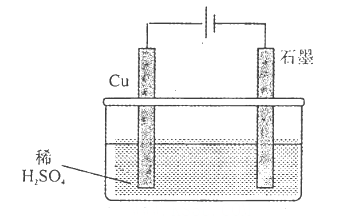
A.电解初期,石墨电极上有H2产生
B.整个电解过程中,H+的浓度不断增大
C.电解一定时间后,石墨电极上有铜析出
D.电解初期,总反应方程式为:

难度: 中等查看答案及解析
-
如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是( )。
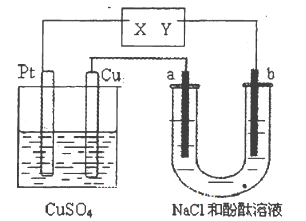
A.X是正极,Y是负极 B.X是负极,Y是正极
C.CuSO4溶液的浓度逐渐减小 D.CuSO4溶液的pH减小
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH
溶液,其充、放电按下式进行:
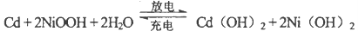
有关该电池的说法正确的是( )。
A.充电时阳极反应:
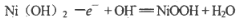
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 中等查看答案及解析
-
今有两种盐的稀溶液,分别是a mol
NaX溶液和b mol
NaY溶液,下列说法不正确的是( )。
A.若a=b,pH(NaX)>pH (NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c (Y-)+c(HY) ;则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时, 酸性HX<HY
D.若两溶液等体积混合,测得
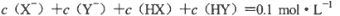
则可推出a+b=0.2 mol
难度: 中等查看答案及解析
 其平衡常数K和温度,的关系如下:
其平衡常数K和温度,的关系如下:
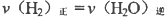 B.混合气体中CO浓度不变
B.混合气体中CO浓度不变