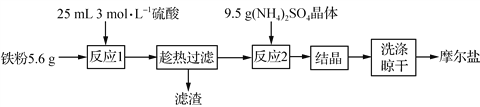
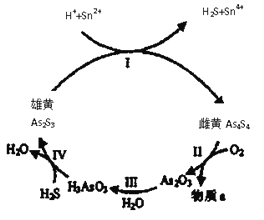
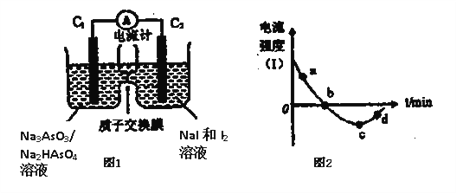
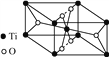
-
化学与生产、生活、科技、环境等密切相关,下列说法不正确的是
A. 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气
B. 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
C. 大力实施矿物燃料脱硫脱硝技术,能减少二氧化硫、氮氧化物的排放
D. 纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是 ( )
A.氯乙烯分子的结构简式:H3C-CH2Cl
B.硫原子的结构示意图:
C.过氧化钠的电子式:
D.中子数为10的氧原子:
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. SO2具有还原性,可用于漂白纸浆
B. NH4HCO3受热易分解,可用作氮肥
C. 氢氧化铝具有弱碱性,可用作净水剂
D. 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
难度: 简单查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z,沸点:X2Z>YX3
C. X、Y、Z三种元素形成的化合物中不可能含离子键
D. YM3、WM4分子中每个原子最外层均满足8电子结构
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 将铜丝插入浓硝酸中:Cu+4H++2NO3-=== Cu2++2NO2↑+2H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe === 2Fe2+
C. 向NaAlO2溶液中通入少量CO2 制Al(OH)3: CO2 + AlO2- + 2H2O =Al(OH)3↓+ HCO3-
D. 用氨水吸收足量的SO2气体:2OH-+SO2=SO32- + H2O
难度: 中等查看答案及解析
-
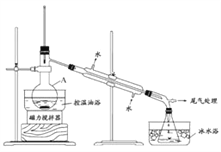
下列实验操作正确的是
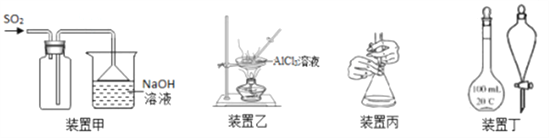
A. 用装置甲收集SO2
B. 用装置乙制备AlCl3晶体
C. 用装置丙进行中和滴定时,滴定前锥形瓶先用待装液润洗
D. 装置丁中使用分液漏斗和容量瓶时,先要检查仪器是否漏液
难度: 中等查看答案及解析
-
下列说法正确的是
A. 化学反应的焓变与反应的途径有关
B. 室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C. 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D. 等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多
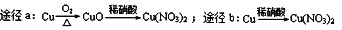
难度: 中等查看答案及解析
-
用H2O2溶液处理含NaCN的废水,反应原理为NaCN+H2O2+H2O=NaHCO3+NH3,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是
A. 该反应中氮元素被氧化
B. 该反应中H2O2作还原剂
C. 每生产0.1mol NaHCO3转移电子数约为0.1×6.02×1023个
D. 实验室配制NaCN溶液时,需加入适量的NaOH溶液
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A.
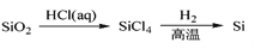
B.
C.

D.

难度: 中等查看答案及解析
-
图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是
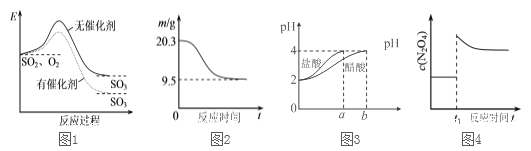
A. 图1表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图2表示0.lmolMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
C. 图3表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>l00
D. 图4表示平衡2NO2(g)
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
难度: 中等查看答案及解析
-
制备K3Fe(C2O4)3·3H2O的实验中,过滤出产品后,常温下另取母液向其中加入指定物质,反应后溶液中可大量存在的一组离子是
A. 加入过量稀硫酸:K+、Fe2+、H+、C2O42-
B. 加入过量铜粉:K+、Fe2+、Fe3+、Cu2+、C2O42-
C. 通入适量SO2气体:K+、Fe3+、C2O42-、SO32-
D. 加入过量 NaOH 溶液:K+、Na+、C2O42-、OH-
难度: 困难查看答案及解析
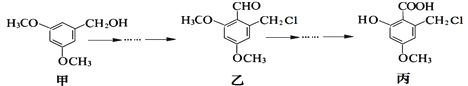
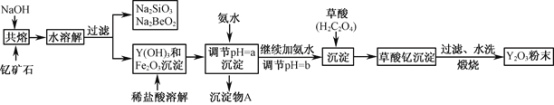
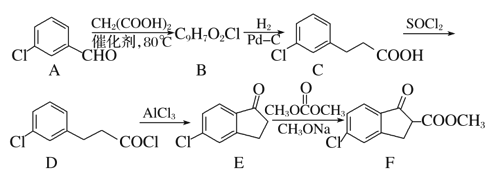
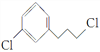 为原料制备化合物E(
为原料制备化合物E(