-
中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( )
A.使用光催化剂不改变反应速率
B.使用光催化剂能增大NO的转化率
C.升高温度能加快反应速率
D.改变压强对反应速率无影响
难度: 简单查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )

A.1mol N2(g)和1mol O2(g)反应放出的能量为180kJ
B.1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
难度: 简单查看答案及解析
-
下列关于金属腐蚀正确的是 ( )
A.金属在潮湿空气中的腐蚀的实质是;M+nH2O===M(OH)n+
H2↑
B.金属的化学腐蚀的实质是M-ne-===Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属不会发生电化学腐蚀
难度: 简单查看答案及解析
-
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)
Sn(s、白) △H3=+2.1kJ/mol下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
难度: 简单查看答案及解析
-
下列叙述中,正确的是( )
A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g) + 2O2(g) === CO2(g) + 2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:
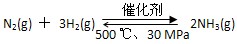 ΔH=-38.6 kJ·mol-1
ΔH=-38.6 kJ·mol-1C.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
D.常温下,反应C(s) + CO2(g) === 2CO(g)不能自发进行,则该反应的ΔH>0
难度: 简单查看答案及解析
-
下列反应中,在高温下不能自发进行的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
氯原子对O3分解有催化作用:O3 +Cl === ClO+O2 ΔH1 ; ClO +O === Cl +O2 ΔH2大气臭氧层的分解反应是:O3 + O===2O2 ΔH,该反应的能量变化如图:
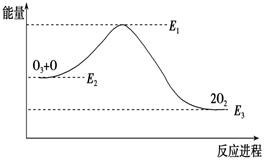
下列叙述中,正确的是( )
A.反应O3 + O === 2O2的ΔH=E1-E3
B.O3 + O === 2O2是吸热反应
C.ΔH=ΔH1+ΔH2
D.大气层中的臭氧无法再生
难度: 简单查看答案及解析
-
已知4NH3+5O2
4NO+6H2O,若化学反应速率分别是用v(NH3)、v(O2)、v(NO)、v(H2O)〔单位:mol·(L·s)-1〕表示,则正确的关系是( )
A. 4/5 V(NH3) = V(O2) B. 5/6 V(O2) = V(H2O)
C. 2/3 V(NH3) = V(H2O) D. 4/5 V(O2) = V(NO)
难度: 简单查看答案及解析
-
在某温度下,可逆反应mA(g) + nB(g)
pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )
A.增加A的量,平衡正向移动,达到新平衡时K值增大
B.升高温度,K值增大
C.K越大,说明该反应的进行程度越大,转化率越高
D.该反应的K=
难度: 简单查看答案及解析
-
反应N2O4(g)
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.B、C两点的反应速率:B=C
C.A、C两点混合气体的平均相对分子质量:A>C
D.由状态B到状态A,可以用加热的方法
难度: 简单查看答案及解析
-
在密闭容器中发生反应:mA(g)+nB(g)
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,下列说法错误的是 ( )
A. m+n〈p B. 平衡向逆反应方向移动
C. A的转化率降低 D. C的体积分数增加
难度: 简单查看答案及解析
-
工业上合成氨时一般采用500℃左右的温度,其原因( )
⑴适当提高氨的合成速率 ⑵提高H2的转化率
⑶提高氨的产率 ⑷催化剂在500℃时活性最大
A.只有⑴ B.⑴⑷ C.⑵⑶⑷ D.⑴⑵
难度: 简单查看答案及解析
-
某密闭容器中发生如下反应:X(g) + 3Y(g)
2Z(g) ΔH<0
如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,
但都没有改变各物质的初始加入量。下列说法中正确的是( )

A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
难度: 简单查看答案及解析
-
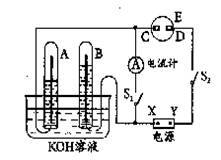
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是 ( )
A.溶液中阴离子向正极移动
B.溶液中阴离子物质的量减少
C.负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑
D.正极的电极反应式是:O2+4H++4e-=2H2O
难度: 简单查看答案及解析
-
已知:2SO2(g)+O2(g)
2SO3(g);△H=-Q kJ·mol-1(Q>0),向密闭恒容容器甲中通入l mol SO2和0.5 mol O2,向另一密闭恒容容器乙中通入2 mol SO2和1 mol O2,起始时两容器中气体的温度和压强相同,反应达到平衡时,两容器中气体的温度和压强仍相同,此时甲中放出的热量为Ql kJ,乙中放出的热量为Q2 kJ。则下列关系式正确的是 ( )
A.2Q1=Q2<Q B.2Ql<Q2<Q
C.2Q1=Q2=Q D.Q1<Q2=Q
难度: 简单查看答案及解析
-
已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽.共放出x kJ热量.已知单质碳的燃烧热为y kJ·mol-1,则1 mol C与O2反应生成CO的反应焓变△H为 ( )
A.-y kJ·mol-1 B.-(5x-0.5y)kJ·mol-1
C.-(10x-y)kJ·mol-1 D.(10x-y)kJ·mol-1
难度: 简单查看答案及解析
-
按右图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液。通电一 段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5 g (不考虑水的蒸发)。 则下列叙述中正确的是 ( )

A.电源P极为正极
B.标准状况下,b极产生气体的体积为5.6 L
C.c极上析出固体的质量为16 g
D.a极上所发生的电极反应式为40H--4e-= 2H2O+O2↑
难度: 简单查看答案及解析
-
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是 ( )

A.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.容器中发生的反应可表示为:3X(g)+Y(g)
2Z(g)
难度: 简单查看答案及解析