-
下列物质属于电解质的是
A. Cl2 B. KNO3 C. SO2 D. Al
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A. 氯原子的电子排布式3s23p5
B. Cl-的结构示意图
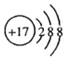
C. 氯离子的电子式Cl-
D. 质量数为37的氯原子1737Cl
难度: 中等查看答案及解析
-
用盐酸滴定NaOH溶液的实验中,不必用到的是
A. 甲基橙 B. 圆底烧瓶 C. 锥形瓶 D. 滴定管
难度: 中等查看答案及解析
-
不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率
B. 过量空气有利于SO2转化为SO3
C. 打开汽水瓶盖,即有大量气泡逸出
D. 配置FeCl3溶液时,加入少量盐酸
难度: 中等查看答案及解析
-
关于下图装置工作时的叙述错误的是

A. 锌作负极
B. 铜片上有气泡产生
C. 将电能转化为化学能
D. 锌片的电极反应式为:Zn -2e→Zn2+
难度: 中等查看答案及解析
-
下列反应中,反应物的用量或浓度改变时,不会改变生成物的是
A. 铜与硝酸反应 B. 明矾溶液与烧碱溶液反应
C. 碳酸钠溶液和盐酸反应 D. 硫在氧气中燃烧
难度: 困难查看答案及解析
-
Al、Fe都是重要的金属元素.下列说法正确的是
A. 两者对应的氧化物均为碱性氧化物
B. 两者的单质都不能与氢氧化钠溶液反应
C. 常温条件下,两种金属都能溶解于浓硫酸中
D. 制备AlCl3、FeCl3,均不能采用将其溶液直接蒸干的方法
难度: 困难查看答案及解析
-
下面是合成氨的简要流程示意图:

沿x路线回去的物质是 ( )
A.N2和H2 B.催化剂 C.N2 D.H2
难度: 简单查看答案及解析
-
下列关于实验室制备乙酸乙酯和乙酸丁酯的描述正确的是
A.均采用水浴加热 B.制备乙酸丁酯时正丁醇过量
C.均采用边反应边蒸馏的方法 D.制备乙酸乙酯时乙醇过量
难度: 简单查看答案及解析
-
元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A. 同一元素不可能既表现金属性,又表现非金属性
B. 第三周期主族元素的最高正化合价等于它所处的主族序数
C. 短周期元素形成离子后,最外层都达到8电子稳定结构
D. 同一主族的元素的原子,最外层电子数相同,化学性质完全相同
难度: 中等查看答案及解析
-
下列烃在光照下与氯气反应,只生成一种一氯代物的有
A. 2-甲基丙烷 B. 异戊烷
C. 乙苯 D. 2,2 - 二甲基丙烷
难度: 困难查看答案及解析
-
下列对同系物归纳错误的是
A. 同系物都符合同一通式
B. 同系物彼此在组成上相差一个或若干个某种原子团
C. 同系物具有相同的最简式
D. 同系物的结构相似
难度: 中等查看答案及解析
-
下列有关实验事实的解释正确的是
A. 高锰酸钾溶液中通入SO2后,颜色褪去,SO2表现了漂白性
B. 铁粉投入同浓度的Cu(NO3)2和AgNO3混合液先析出Ag,说明Ag+氧化性比Cu2+强
C. 常温下,将铝片放入浓硫酸中无明显现象,说明铝和冷的浓硫酸完全不反应
D. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
难度: 困难查看答案及解析
-
下列物质中含有NA个氯化氢分子的是
A. 将lmol H2和1molCl2光照或点燃后的产物
B. 6.02×1023个HCl气体分子
C. 室温下,将1molHCl气体通入100mL水中所得溶液
D. 室温下,73gHCl气体
难度: 中等查看答案及解析
-
1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是
A. C(s)+O2(g)→CO2(g)+393kJ
B. C + O2→ CO2+393kJ
C. C (s) + O2 (g)→CO2 (g)-393kJ
D. C (s) +1/2O2 (g) → CO(g) +393kJ
难度: 中等查看答案及解析
-
下列实验事实可用来证明氨水是弱碱的是
A. 氨水能跟氯化铝溶液反应生成氢氧化铝沉淀
B. 铵盐受热易分解
C. 1mol/L 的氨水可以使酚酞试液变红
D. 常温下0.1mol/L的氯化铵溶液的pH为5
难度: 困难查看答案及解析
-
下列性质递变不正确的是
A. 酸性: HClO4>H2SO4>H3PO4
B. 半径:Cl-> Na+>F-
C. 热稳定性:HF> H2O> PH3
D. 还原性:Cl- < Br-< I-
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 氨气溶于醋酸溶液:NH3+H+→NH4+
B. 将硫化氢气体通入足量氢氧化钠溶液中,H2S+2OH-→S2-+2H2O
C. 向氯化亚铁溶液中加入溴水:Fe2++Br2→Fe3++2Br-
D. 碳酸氢钠溶液中加入足量的石灰水:2HCO3-+Ca2++2OH-→CaCO3↓+CO32-+2H2O
难度: 困难查看答案及解析
-
丙烯醛(结构简式为CH2=CH-CHO)能发生的化学反应有
①加成 ②消除(消去) ③取代 ④氧化 ⑤还原 ⑥加聚 ⑦缩聚
A. ①③⑤⑦ B. ②④⑥ C. ①④⑤⑥ D. ③④⑤⑥
难度: 中等查看答案及解析
-
对于反应:KClO3 + 6HCl → KCl +3Cl2↑ + 3H2O,若有0.1molKClO3参加反应,下列说法正确的是
A. 被氧化的 HCl为0.6mol
B. 转移电子1.806×1023个
C. 产生气体为6.72L
D. 还原剂占参加反应HCl的5/6
难度: 困难查看答案及解析


