-
化学与生活、生产、环境等密切相关,下列说法正确的是( )
①在饲料中加入“瘦肉精”,人食用猪肉后能降低“高血脂”的发病率;
②自备购物袋,不用塑料方便袋;
③建立空调凝结水和屋面雨水收集系统,充分利用水资源;
④大力发展、推广可利用太阳能、风能的城市照明系统;
⑤可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大;
⑥用填埋法处理未经分类的生活垃圾;
⑦明矾可以用来净水,是利用明矾水解生成Al(OH)3胶体,从而起到杀菌消毒功效;
⑧Mg可由电解熔融的MgCl2制取,Al也可由电解熔融AlCl3制取.
A.②③④⑤ B.②③④⑥⑧ C.①②③④⑤ D.②③④⑤⑦
难度: 中等查看答案及解析
-
下列有机物的说法正确的是( )
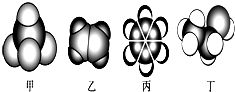
A.C5H12有2种同分异构体
B.C4H10O属于醇的结构有5种
C.甲、丙分别是CH4、苯的比例模型,乙能发生加成反应,丁在一定条件下能转化为乙
D.甲、乙能发生氧化反应,丙、丁不能发生氧化反应
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.常温常压下,0.1mol铁在0.1molC12中充分燃烧,转移的电子数为0.3NA
C.0.1mol/L的K2CO3溶液中CO32﹣数小于0.1NA
D.
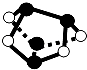
0.5mol雄黄(As4S4,结构如图)含有NA个S﹣S键
难度: 简单查看答案及解析
-
下列有关离子方程式,正确的是( )
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3﹣═Fe3++NO↑+2H2O
B.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3﹣+2OH﹣
NH3↑+CO32﹣+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3﹣+H2O⇌CO32﹣+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
难度: 简单查看答案及解析
-
某溶液中可能存在Br﹣、CO32﹣、SO32﹣、Al3+、I﹣、Mg2+、Na+等七种离子中的几种.现取该溶液进行实验,有如下实验现象:据此可以推断,该溶液中肯定不存在的离子是( )
①向溶液中滴加足量氯水后,溶液变橙色,且有无色无味气体产生
②向所得橙色溶液中滴加足量BaCl2溶液,无沉淀生成
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
A.Mg2+、Na+、CO32﹣、I﹣ B.Al3+、Na+、SO32﹣、I﹣
C.Al3+、Mg2+、SO32﹣、I﹣ D.Al3+、CO32﹣、Br﹣、SO32﹣
难度: 简单查看答案及解析
-
金属Cu和一定浓度的HNO3反应:生成NO、NO2、N2O4,生成的气体恰好与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳在加热时反应,所产生的CO2的量( )
A.小于0.5 mol B.等于0.5 mol C.大于0.5mol D.无法确定
难度: 简单查看答案及解析
-
下列有关说法不正确的是( )
A.25℃时,0.1mol•L﹣1的三种溶液的pH关系为:pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相等
C.25℃时,BaCO3在纯水中的KSP比在Na2CO3溶液中的KSP大
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+2c(CO32﹣)
难度: 简单查看答案及解析
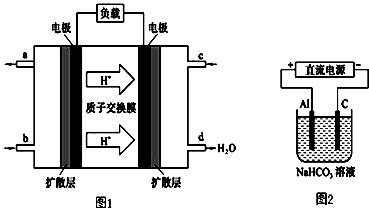
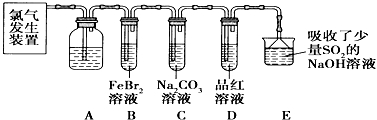
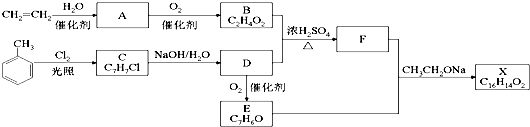
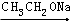 RCH=CHCOOR′.请回答:
RCH=CHCOOR′.请回答: