-
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.减少CO2的排放,可以减少酸雨的产生
B.减少SO2的排放,可以从根本上消除雾霾
C.新材料碳纤维,是一种新型有机高分子材料
D.CO2合成聚碳酸酯可降解塑料,以实现“碳”的循环利用
难度: 简单查看答案及解析
-
下列有关化学用语表示错误的是
A.HCN的结构式:H-C≡N
B.HClO的电子式为:
C.HOCH2COOH缩聚物的结构简式:
D.2-氯甲苯的结构简式:
难度: 简单查看答案及解析
-
常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.中性溶液:Cu2+、Al3+、NO3-、SO42-
B.加入苯酚显紫色的溶液:K+、NH4+、Cl-、NO3-
C.加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42-
D.常温下,c(H+)/c(OH一)=1×10 12的溶液:K+、AlO2-、CO32-、Na+
难度: 中等查看答案及解析
-
下列有关物质性质的应用错误的是
A.二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸
B.碳酸氢钠具有弱酸性,可用于食品发酵
C.次氯酸钠具有强氧化性,可用于配制消毒液
D.明矾能水解生成Al(OH)3胶体,可用作净水剂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.标准状况下,11.2 L NO和11.2 L SO3的分子总数为0.5NA
B.0.1molBr2与足量H2O或NaOH反应转移的电子数均为0.1NA
C.0.1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA
D.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA
难度: 中等查看答案及解析
-
下列有关实验正确的是
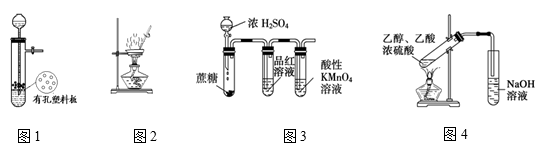
A.图1装置用于Cu和浓H2SO4反应制取少量的SO2气体
B.图2装置用于灼烧Al(OH)3
C.图3装置用于检验浓硫酸与蔗糖反应产生的二氧化硫
D.图4装置由于实验室制备乙酸乙酯
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.Na2C2O4水【解析】
C2O42-+2H2O=H2C2O4+2OH-B.AgOH溶于氨水:AgOH+2NH3·H2O=[Ag(NH3)2]++OHˉ+2H2O
C.向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O
难度: 中等查看答案及解析
-
下列A-D各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
甲
乙
丙
A
Al2O3
HNO3
Ba(OH)2
B
NH3
O2
H2SO4
C
SiO2
NaOH
HF
D
CO2
Na2O2
H2O
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法正确的是
A.微粒半径:Z2+>W2->R-
B.对应氢化物的稳定性:W>R
C.W与X、W与Z形成的化合物晶体类型相同
D.Y的最高价氧化物对应的水化物是弱酸
难度: 中等查看答案及解析
-
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图。下列有关说法正确的是
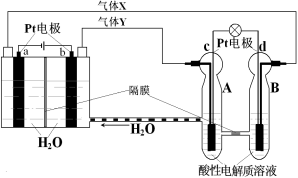
A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L
B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
难度: 困难查看答案及解析
-
下列有关说法正确的是
A.钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生
B.反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的ΔH>0
C.由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3 沉淀
D.25℃时,0.1 mol·L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大
难度: 中等查看答案及解析
-
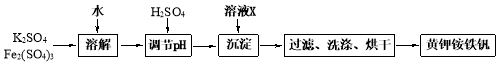
新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
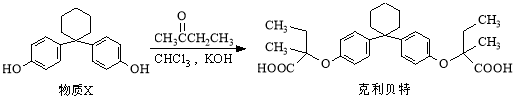
下列有关叙述正确的是
A.克利贝特的分子式为C28H34O6
B.物质X分子中所有碳原子可能位于同一平面内
C.用饱和NaHCO3溶液可以鉴别物质X和克利贝特
D.1 mol物质X最多可以与含2 molBr2的溴水反应
难度: 中等查看答案及解析
-
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol·L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是

A.图中A点对应溶液的pH:a=1
B.生成沉淀的最大质量m=2.33g
C.原混合液中c(HCl)=0.2mol·L-1
D.当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+)
难度: 困难查看答案及解析
-
25℃时,下列各溶液中有关微粒物质的量浓度关系正确的是
A.0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S)
B.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
C.0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合:c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+)
D.0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+)
难度: 困难查看答案及解析
-
一定条件下存在反应C(s)+H2O(g)
CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器
甲
乙
丙
容积
0.5 L
0.5 L
V
温度
T1 ℃
T2 ℃
T1 ℃
起始量
2 molC
1 molH2O
1 molCO
1 molH2
4 molC
2 molH2O
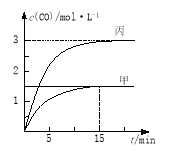
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V>0.5L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2
难度: 困难查看答案及解析